
科目:高中化学 来源: 题型:选择题
| A. | 将两种带相反电荷的胶体混合,能发生聚沉 | |
| B. | 有化学键断裂的变化一定是化学变化 | |
| C. | IA族元素形成的单质的熔点随原子序数的递增而降低 | |
| D. | 碱性氧化物一定是金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
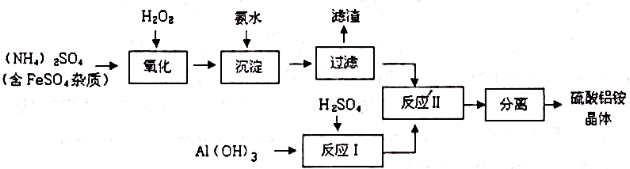

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液 | B. | NaCl固体 | C. | NaOH溶液 | D. | CaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”). .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2O的质量为18g | |
| B. | 摩尔是表示物质微粒数目的一个物理量 | |
| C. | 3.01×1023个SO2分子的质量为64g | |
| D. | 标准状况下,1 mol任何物质体积均约为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com