
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由强到弱的顺序是 ( )
| A.①③④② | B.①③②④ | C.③④②① | D.③①②④ |
科目:高中化学 来源: 题型:
(1) 20世纪30年代,Eyring和Pzer在碰撞
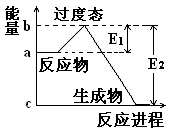 理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,
理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,

 说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。
说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。
 (2)在某体积为2L的密闭容器中充入1.5mol NO2和2mol CO,在一定条件下发生反应:NO2+CO
(2)在某体积为2L的密闭容器中充入1.5mol NO2和2mol CO,在一定条件下发生反应:NO2+CO CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:①此段时间内,用CO2表示的平均反应速率为 ②2 min时,容器内气体的总物质的量为_________.
CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:①此段时间内,用CO2表示的平均反应速率为 ②2 min时,容器内气体的总物质的量为_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为( )
A.0.01 mol/L B.0.017 mol/L
C.0.05 mol/L D.0.50 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
现使用酸碱中和滴定法测定市售白醋的总酸量(g/100 mL)。
Ⅰ.实验步骤:
 (1)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪器名称)中定容,摇匀即得待测白醋溶液。
(1)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴________作指示剂。
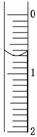
(3)读取盛装0.100 0 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________ mL。
(4)滴定。当____________________________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录:
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.实验处理:
(1)某同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=(15.95+15.00+15.05+14.95)/4 mL=15.24 mL。
指出他的计算的不合理之处:______________;按正确数据处理,可得市售白醋总酸量=________ g/100 mL。(结果保留四位有效数字)
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号)________。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法或表示方法中正确的是 ( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石)→C(石墨)ΔH= -1.9KJ/mol 可知,金刚石比石墨稳定
C.在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气的燃烧热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH= - 285.8KJ/mol
D. 稀硫酸与稀NaOH溶液反应的中和热为ΔH= -57.3 kJ /mol
查看答案和解析>>
科目:高中化学 来源: 题型:
PCl5的热分解反应如下:PCl5(g) PCl3(g) + Cl2(g)
PCl3(g) + Cl2(g)
(1)写出反应的平衡常数表达式K=___________________________________
(2)已知某温度下,在容积为10.0L的密闭容器中充入2.00mol PCl5,达到平衡后,测得容器内PCl3的浓度为0.150mol/L。计算该温度下的平衡常数K=_________
(3)若在与(2)相同的温度条件下,保持容器体积不变,初始充入1.00mol PCl5,达到平衡后,测得容器内PCl3的浓度为a mol/L。则a ____ 0.075mol/L(<、>、=)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某可逆反应:mA(g) + nB(g)  pC(g) ?H= Q kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
pC(g) ?H= Q kJ·mol-1,在密闭容器中进行,右图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是
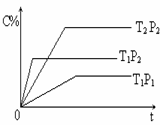 A.T1 <T2 P1>P2 m+n<P Q<0
A.T1 <T2 P1>P2 m+n<P Q<0
B.T1>T2 P1<P2 m+n>P Q>0
C.T1<T2 P1<P2 m+n<P Q>0
D.T1>T2 P1<P2 m+n>P Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
对于等质量的SO2和SO3来说,下列关系中正确的是 ( )
A.含氧原子的个数比为2:3 B. 含硫元素的质量比为5:4
C. 含氧元素的质量比为6:5 D. 含硫原子的个数比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于纸色谱法分离Fe3+和Cu2+操作正确的是( )
A.裁滤纸应垂直纤维方向裁开
B.点样时,斑点尽量小,且再点时必须在同一位置
C.展开时,用流动相溶剂刚好淹过色斑进行展开
D.当流动相溶剂上升至滤纸上沿时,取出晾干观察
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com