
| A.胶体粒子能透过滤纸,但不能透过半透膜 |
| B.胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 |
| C.只有胶体粒子能做布朗运动 |
| D.向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失 |
 Fe(OH)3+3HCl,在加热条件下,由于HCl易挥发,生成物浓度减小,导致平衡不断向右移动,故最后不能得到FeCl3固体
Fe(OH)3+3HCl,在加热条件下,由于HCl易挥发,生成物浓度减小,导致平衡不断向右移动,故最后不能得到FeCl3固体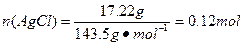
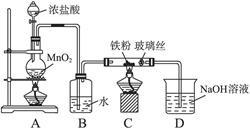
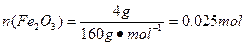 ,依据Cl、Fe守恒3x mol+2y mol="0.12" mol,x mol+y mol="0.025" mol×2,解得x=0.02,y=0.03。(8)因为FeCl3易水解,所以其制备应在无水的条件下进行,即C装置中应干燥,并防止水分进入。
,依据Cl、Fe守恒3x mol+2y mol="0.12" mol,x mol+y mol="0.025" mol×2,解得x=0.02,y=0.03。(8)因为FeCl3易水解,所以其制备应在无水的条件下进行,即C装置中应干燥,并防止水分进入。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe Cu Al Ag Mg |
| B.Al Cu Mg Ag Fe |
| C.Mg Cu Al Ag Fe |
| D.Mg Ag Al Cu Fe |
查看答案和解析>>
科目:高中化学 来源:不详 题型:判断题
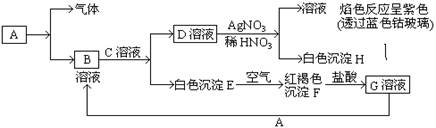
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe(OH)3、Al(OH)3 | B.Al(OH)3、I2? |
| C.Fe2S3、I2 | D.FeS、S、Al(OH)3? |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
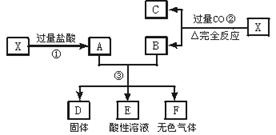
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com