

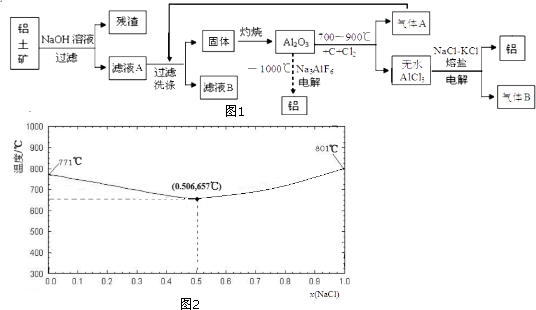
分析 B、C同周期左右紧邻且二者能形成多种常见有害于大气的气态化合物,B为N元素,C为O元素,可形成氮氧化物.A元素原子序数与周期序数相同,则A为H元素,E处于第四周期且其基态原子价层电子排布式为md2mnsn-2.由于为前四周期元素,则n=4,m=3,则E为Fe元素,D是所在周期的原子序数最大的金属元素,结合原子序数应为第三周期元素,故D为Al.
(1)BA3分子为氨气,为三角锥形结构,N的最外层为半充满状态,第一电离能大于O元素的;
(2)与D元素同族的短周期元素M为硼元素,结合均摊法计算晶胞中B、N原子数目进而确定化学式;
(3)H2O2具有强氧化性,将Fe2+氧化生成Fe3+,自身被还原生成H2O;
(4)Al能与氢氧化钠溶液反应生成偏铝酸钠与氢气,Al为负极;
(5)由图可知,1mol BA4+(aq)全部氧化成BC3-(aq)共放出的热量为273kJ+73kJ=346kJ,注明物质的聚集状态与反应热书写热化学方程式.
解答 解:B、C同周期左右紧邻且二者能形成多种常见有害于大气的气态化合物,B为N元素,C为O元素,可形成氮氧化物.A元素原子序数与周期序数相同,则A为H元素,E处于第四周期且其基态原子价层电子排布式为md2mnsn-2.由于为前四周期元素,则n=4,m=3,则E为Fe元素,D是所在周期的原子序数最大的金属元素,结合原子序数应为第三周期元素,故D为Al.
(1)BA3分子为氨气,为三角锥形结构,N的最外层为半充满状态,第一电离能大于O元素的,
故答案为:三角锥形;N>O(或O<N);
(2)与Al元素同族的短周期元素M为硼元素,由晶胞可知B原子半径较大,位于定点和体心,数目为1+8×$\frac{1}{8}$=2,N位于棱和体心,数目为4×$\frac{1}{4}$+1=2,则比值为1:1,化学式为BN,
故答案为:2;BN;
(3)A、C两元素形成原子个数比1:1的化合物在酸性条件下能将E2+氧化,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)Al为负极,被氧化生成AlO2-,电极方程式为Al-3e-+4OH-=AlO2-+2H2O,
故答案为:Al-3e-+4OH-=AlO2-+2H2O;
(5)由由图可知,1mol BA4+(aq)全部氧化成BC3-(aq)共放出的热量为273kJ+73kJ=346kJ,则热化学方程式为:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l)△H=-346 kJ/mol,
故答案为:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l)△H=-346 kJ/mol.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,综合考查学生分析能力、逻辑推理能力及对知识的迁移运用,需要学生具备扎实的基础.


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | 还原性:F->Cl->Br->I- | |
| B. | 酸性:碳酸>石碳酸>碳酸氢钠>氢氧化铝 | |
| C. | 氧化性:Na>S>F2>O2 | |
| D. | NaHCO3溶液:c(HCO3-)>c(CO32-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

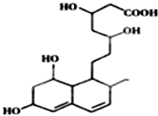
| A. | 化合物A的分子式为C15H21O3 | |
| B. | 化合物A是芳香族化合物 | |
| C. | 化合物A可以发生取代反应、加成反应、酯化反应和银镜反应 | |
| D. | 1mol化合物A最多可与1molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题


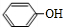 ,G
,G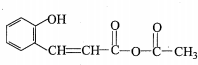 .
. .
. 氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式
氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式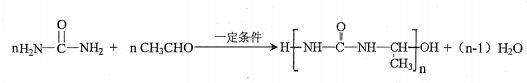 .
.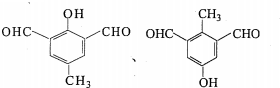 (任一种).
(任一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol HI(g) | B. | 2 mol H2(g)和1 mol I2(g) | ||
| C. | 1 mol H2(g)和2 mol I2(g) | D. | 1 mol I2(g)和2 mol HI(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,该分子中氮原子的杂化方式为sp2和sp3.
,该分子中氮原子的杂化方式为sp2和sp3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能与FeCl3溶液发生显色反应 | |
| B. | 能发生加成、酯化、氧化反应 | |
| C. | 1mol该物质与足量Na反应,产生2.5gH2 | |
| D. | 能使溴水和酸性高锰酸钾溶液褪色,褪色原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Co2+ | 7.2 | 9.2 |
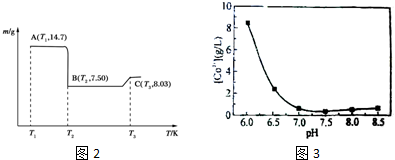
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com