
【题目】化合物G是一种药物合成中间体,其合成路线如下:
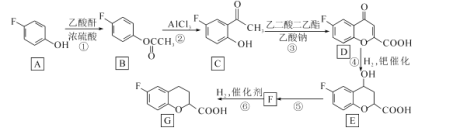
已知:乙酸酐的结构简式为![]() 。请回答下列问题:
。请回答下列问题:
(1)G中含氧官能团的名称是______________
(2)反应①的化学方程式为__________________
(3)反应⑤所需的试剂和条件是____,该反应类型是______________
(4)写出满足下列条件的C的同分异构体的结构简式________________________。
I.苯环上只有两种取代基;Ⅱ,核磁共振氢谱图中只有4组吸收峰;Ⅲ.能与NaHCO3溶液反应生成CO2。
(5)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。则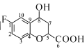 中的手性碳是____(填碳原子的数字标号)。
中的手性碳是____(填碳原子的数字标号)。
(6)设计以![]() 为原料制备
为原料制备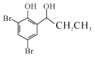 的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。
_____________________________________
【答案】羧基、醚键  浓硫酸、加热 消去反应
浓硫酸、加热 消去反应 ![]() 、
、![]() 5、8
5、8 
【解析】
(1)根据G的结构简式,分析含有的含氧官能团;
(2)对比A和B的结构简式,反应①为取代反应,据此书写方程式;
(3)E→F→G过程中,消除了E中的羟基,因此反应⑤为消去反应,据此分析判断;
(4)C的同分异构体的核磁共振氢谱有4组峰,说明是对称结构,能与NaHCO3反应,说明含有羧基,据此分析和判断;
(5)利用手性碳原子的定义进行分析;
(6)对比原料和目标产物结构的异同,利用题给信息和所学知识设计合成路线。
(1)根据G的结构简式,G中的含氧官能团是醚键、羧基;
(2)对比A和B的结构简式,A中氧氢键断裂,乙酸酐中 ,从虚线中断裂,该反应为取代反应,反应方程式为
,从虚线中断裂,该反应为取代反应,反应方程式为 ;
;
(3) F→G显然发生加成反应,说明F中含有不饱和键,即E生成F发生消去反应,所需试剂和条件为浓硫酸、加热;
(4)C的同分异构体的核磁共振氢谱有4组峰,说明是对称结构,两个取代基位置应是对位,能与NaHCO3溶液反应,说明含有羧基,即符合条件的同分异构体是![]() 、
、![]() ;
;
(5)根据手性碳原子的定义,属于手性碳原子是5、8;
(6)对比原料和目标产物,模仿B→C,先让![]() 在AlCl3发生反应生成
在AlCl3发生反应生成 ,然后羰基与H2在钯作催化剂下,发生加成反应,由于酚羟基的影响,使得苯环上的邻位和对位上的氢变得活泼,容易发生取代,最后与浓溴水发生取代反应,即合成路线为
,然后羰基与H2在钯作催化剂下,发生加成反应,由于酚羟基的影响,使得苯环上的邻位和对位上的氢变得活泼,容易发生取代,最后与浓溴水发生取代反应,即合成路线为 。
。


科目:高中化学 来源: 题型:
【题目】下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中K+、Fe2+、SCN-、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3++2I-===Fe2++I2
C.和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-==Fe(OH)3↓+BaSO4↓
D.1 L 0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”。例如,下列有机物分子中带“*”碳原子就是手性碳原子。该有机物分别发生下列反应,生成的有机物分子中仍含有手性碳原子的是

A. 与银氨溶液作用发生银镜反应B. 催化剂作用下与![]() 反应
反应
C. 与乙酸发生酯化反应D. 与NaOH溶液加热条件下反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镓( GaN)是制造SG芯片的材料,氮化铝LED灯可发出紫外光。回答下列问题:
(1) Ga的价电子排布式为____,该基态原子占据最高能级的电子云轮廓图形状为________。
下列状态的铝中,电离最外层的一个电子所需能量最小的是____(填字母)。
![]()
(2)8 -羟基喹啉铝常用于发光材料及电子传输材料,可由LiAlH4与 合成。LiAlH4中阴离子的空间构型为_____________,
合成。LiAlH4中阴离子的空间构型为_____________, 所含元素中电负性最大的是____(填元素符号),N的杂化方式为________________
所含元素中电负性最大的是____(填元素符号),N的杂化方式为________________
(3)金属晶体Al、Ga的熔点分别为660℃、30℃,Al比Ga熔点高的原因是____________
(4)氮化镓为六方晶胞,结构如右图所示。该晶体密度为ρg/cm3,晶胞参数a=b≠c(单位:pm),a、b夹角为120°,阿伏加德罗常数的值为NA,则晶胞参数c=____pm(用含a、ρ、NA的代数式表示)。

(5)在立方晶胞中,与晶胞体对角线垂直的面在晶体学中称为(1,1,1)晶面。如右图,该立方晶胞中(1,1,1)晶面共有____个。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500![]() 有
有![]() 和
和![]() 的混合溶液分成5等份,取一份加入含
的混合溶液分成5等份,取一份加入含![]()
![]() 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含![]()
![]() 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应N2(g)+3H2(g)2NH3(g),在1L密闭容器中进行,5min内氨的物质的量增加了0.2mol,则反应速率为( )
A. v(H2)=0.015mol/(L·min)B. v(N2)=0.02mol/(L·min)
C. v(NH3)=0.17mol/(L·min)D. v(NH3)=0.01mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于NaHCO3和Na2CO3的性质判断正确的是( )
A.相同温度下的溶解度:NaHCO3>Na2CO3
B.常温下,相同物质的最浓度溶液的pH:NaHCO3<Na2CO3
C.热稳定性:NaHCO3<Na2CO3
D.等物质的量浓度的两种盐溶液与同浓度、同体积的盐酸反应生成气体的快慢:NaHCO3<Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为Zn-Cu原电池的示意图,请回答:

(1)锌片为原电池的_____极,铜片为原电池的____极(填“正”或“负”)
(2)锌电极反应式是_______,属于______反应(填“氧化”或“还原”);铜电极反应式是______,属于______反应(同上)。
(3)______(填“电子”或“电流”)从锌片通过导线流向铜片,溶液中H+在______(填“锌片”或“铜片”)获得电子。
(4)若锌片减轻0.1mol,则另一极放出气体的物质的量为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下转化关系,E为淡黄色粉末,通常用在呼吸面具中作为氧气的来源。

(1)A、C、E、F的化学式:
A______,C______,E______,F______。
(2)向饱和的C的溶液中通入足量CO2,会出现的现象是_____,有关反应的化学方程式为____。
(3)鉴别C与F溶液应选用的试剂是_____,有关反应的离子方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com