
(16分)合成氨技术的发明使工业化人工固氮成为现实。
(1)已知N2(g)+3H2(g)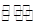 2NH3(g)
2NH3(g) 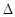 H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。
H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如下图所示。由图可知:
①温度T1、T2时的平衡常数分别为K1、K2,则K1 K2 (填“>”或“<”)。若在恒温、恒压条件下,向平衡体系中通入氦气,平衡 移动、(填“向左”、“向右”或“不”)。
②T2温度时,在1L的密闭容器中加入2.1mol N2、l.5molH2,经10min达到平衡,则v(H2)= 。达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则平衡 移动(填“向左”、“向右”或“不”)。
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g)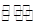 H2O(1)+CO(NH2)2(1) △H,
H2O(1)+CO(NH2)2(1) △H,
在一定压强下测得如下数据: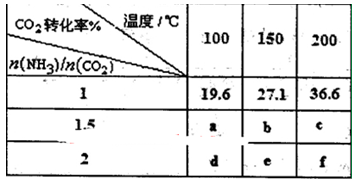
①则该反应△H 0,表中数据a d,b f(均选填“>”、‘‘=”或“<”)。
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理 。
(16分)
(1)69.15kJ(2分)
(2)① >(1分) 向左(1分) ②0.09 mol·L-1·min-1(2分) 向右(2分)
(3)①>(2分) < (2分) <(2分)
②净化后重新充入合成塔内,循环利用,提高原料利用率(2分)
解析试题分析:(1)标准状况下33.6LNH3物质的量为:33.6L÷22.4L/mol=1.5mol,92.2kJ·mol-1÷2×1.5mol=69.15kJ。
(2)①根据图像,B点NH3的百分含量小于A点NH3的百分含量,所以K1 > K2;若在恒温、恒压条件下,向平衡体系中通入氦气,原反应体系气体的压强减小,平衡向气体系数增大的方向移动,即向左移动。
②根据“三段式”进行计算,设N2转化浓度为X,则
N2(g)+3H2(g)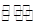 2NH3(g)
2NH3(g)
起始浓度(mol?L?1) 2.1 1.5 0
转化浓度(mol?L?1) X 3X 2X
平衡浓度(mol?L?1)2.1—X 1.5—3X 2X
根据T1时NH3的百分含量为20%,则2X/(2.1—X+1.5—3X+2X)=20%,解得X=0.3,则v(H2)=0.9mol/L÷10min="0.09" mol·L-1·min-1;根据平衡浓度可求平衡常数K=(0.6mol?L?1)2÷[1.8mol/L×(0.6mol?L?1)3]=0.93(mol?L?1)-2,再向该容器内通入N2、H2、NH3各0.4mol,则Q=(1mol?L?1)2÷[2.2mol/L×(1mol?L?1)3]=0.45(mol?L?1)-2,Q < K,所以平衡向右移动。
(3)①根据表中数据,温度升高,CO2的转化率增大,平衡向右移动,所以正反应为吸热反应,?H > 0;n(NH3)/n(CO2)增大,CO2的转化率增大,所以a < d,b <f。
②CO2、NH3为反应物,所以净化后重新充入合成塔内,循环利用,提高原料利用率。
考点:本题考查化学反应与热量变化、反应速率、平衡常数、化学平衡移动、化学计算。


科目:高中化学 来源: 题型:单选题
可逆反应∶2NO2 2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时,生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
| A.①④⑥ | B.②③⑤ | C.①③④ | D.①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)800℃、2L密闭容器反应2NO(g)+O2(g) 2NO2(g)体系中, n(NO)随
2NO2(g)体系中, n(NO)随
时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
 (3) 反应达到平衡状态时NO的转化率= 。(提示 : )
(3) 反应达到平衡状态时NO的转化率= 。(提示 : )查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知:N2O4(g)  2NO2(g) ΔH="+57.20kJ" · mol-1
2NO2(g) ΔH="+57.20kJ" · mol-1
在100℃时,将0.100molN2O4气体充入1L恒容抽空的密闭容器中,每隔一定时间对该容器内的物质浓度进行分析得到下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4) /mol··L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2) /mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)在一定温度下,体积为2 L的密闭容器中,NO2和N2O4之间发生反应:2NO2 (g) (红棕色) N2O4(g) (无色),如图所示。
N2O4(g) (无色),如图所示。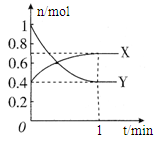
(1)曲线 (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。
(2)若升高温度,则v(正) ,v(逆) 。(填“加快”或“减慢”)。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=18 mol/(L·min),乙中v(N2O4)=0.2 mol/(L·s),则 中反应更快。
(4)在0到1 min中内用X表示该反应的速率是 ,该反应达限度时,Y的转化率 ,反应开始时与反应达平衡状态时的压强之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)将3 mol A和3 mol B混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g)  xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,C的平均反应速率为0.1 mol/(L·min)。试求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,C的平均反应速率为0.1 mol/(L·min)。试求:
(1)B的平均反应速率为 。
(2)x的值为 。
(3)5 min后,A、B的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)以下是一些物质的熔沸点数据(常压):
| | 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 |
| 熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | --- | 4250 |
 2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(18分)运用化学反应原理研究氮、氯等单质及其化合物的反应有重要意义。
(1)科学家研究在一定条件下通过下列反应制备NH3: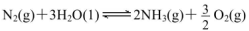
①在其他条件相同时,反应中NH3的体积分数(a)在不同温度下随反应时间(t)的变化如图。该反应的平衡常数表达式K=______,该反应中的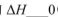 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。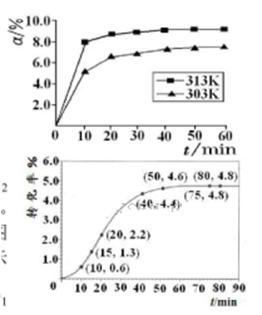
②某温度下,在2L容积不变的密闭容器中加入1molN2和6molH2O(1)发生反应,N2转化率随时间(t)变化如图。15-20min内,v(NH3)=____。若其他条件不变,在图中画出使用催化剂后N2的转化率随反应时间变化的曲线示意图。
(2) 25℃时,某同学将0.lmol 盐酸与0.2 mol
盐酸与0.2 mol 氨水等体积混合,所得混合溶液pH______7(填“>”“<”或“=”,下同),混合溶液中
氨水等体积混合,所得混合溶液pH______7(填“>”“<”或“=”,下同),混合溶液中 (25℃时,NH3.H2O的电离常数
(25℃时,NH3.H2O的电离常数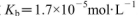 )
)
(3) 25℃时,向O.lmol 的MgCl2溶液中逐滴加入适量0.lmol
的MgCl2溶液中逐滴加入适量0.lmol 氨水,有白色沉淀生成,向反应后的浊液中,继续加入O.lmol
氨水,有白色沉淀生成,向反应后的浊液中,继续加入O.lmol 的FeCl3溶液,观察到的现象是______ ;上述过程中发生的所有反应的离子方程式为______。(25℃时,
的FeCl3溶液,观察到的现象是______ ;上述过程中发生的所有反应的离子方程式为______。(25℃时,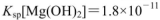 ,
,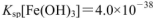 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4 2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)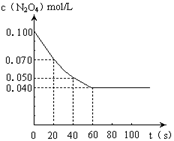
(1)计算在20至40秒时间内,NO2的平均生成速率为 mol?L-1?S -1。
(2)①该反应的化学平衡常数表达式为 。
②求该温度下平衡常数的值。(写出计算过程,下同)
(3)求达到平衡状态时N2O4的转化率。
(4)求平衡时容器内气体压强与反应前的压强之比为多少?(最简整数比)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com