
(4)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=﹣90.8kJ•mol﹣1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=﹣23.5kJ•mol﹣1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=﹣41.3kJ•mol﹣1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g)的△H= ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度e.分离出二甲醚.
考点: 化学平衡的影响因素;用盖斯定律进行有关反应热的计算.
分析: 依据热化学方程式和盖斯定律计算得到;反应达到平衡,要提高CO的转 化率化学平衡正向进行.
化率化学平衡正向进行.
解答: 解:①2H2(g)+CO(g)⇌CH3OH(g)△H=﹣90.8kJ•mol﹣1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=﹣23.5kJ•mol﹣1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=﹣41.3kJ•mol﹣1
由盖斯定律②+③+①×2得到3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)的△H=﹣246.4 kJ•mol﹣1,
一定条件下的密闭容器中,该总反应达到平衡,反应是放热反应,反应前后气体体积减小的反应,要提高CO的转化率,平衡正向进行,
a.压缩体积,压强增大平衡正向进行,一氧化碳转化率增大,温度升高,平衡向吸热的逆向移动,一氧化碳转化率减小,故a不符合;
b.加入催化剂,改变反应速率不改变化学平衡,转化率不变,故b不符合;
c.减少CO2的浓度,减少生成物浓度平衡正向进行,一氧化碳转化率增大,故c符合;
d.增加CO的浓度,提高氢气转化率,一氧化碳转化率减小,故d不符合;
e.分离出二甲醚(CH3OCH3),平衡正向进行,一氧化碳转化率增大,故e符合;
故答案为:﹣246.4 kJ•mol﹣1;c、e.
点评: 本题考查了盖斯定律的计算应用,化学平衡的影响因素分析判断,题目难度中等.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
下列关于反应能量的说法正确的是()
A. Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=﹣216 kJ/mol,则反应物总能量大于生成物总能量
B. 若一定条件下,A═B△H<0,说明A物质比B物质稳定
C. 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=﹣571.6 kJ/mol,则H2的燃烧热为571.6 kJ/mol
D. H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3 kJ/mol,含1 molNaOH的溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流计中有电流通过,则下列说法正确的是()
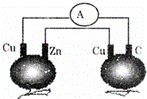
A. 锌片是负极 B. 两个铜片上都发生氧化反应
C. 石墨是阴极 D. 两个番茄都形成原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
某密闭容器中发生如下反应:X(g)+3Y(g)2Z(g)△H<0.下图表示该反应的速率(υ)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是()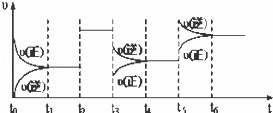
A. t3时降低了温度
B. t5时增大了压强
C. t2时加入了催化剂
D. t4~t5时间内转化率一定最低
查看答案和解析>>
科目:高中化学 来源: 题型:
向四个体积相同的密闭容器(甲、乙、丙、丁)中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小排列顺序正确的是()
甲:在500℃时,10mol SO2和6mol O2反应
乙:在500℃时,用V2O5作催化剂,10mol SO2和5mol O2反应
丙:在450℃时,8mol SO2和5mol O2反应
丁:在500℃时,8mol SO2和5mol O2反应.
A. 甲、乙、丙、丁 B. 乙、甲、丙、丁 C. 乙、甲、丁、丙 D. 丁、丙、乙、甲
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学方程式错误的是 ( )。
A.Ca(HCO3)2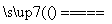 CaCO3↓+CO2↑+H2O
CaCO3↓+CO2↑+H2O
B.Mg(HCO3)2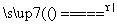 MgCO3↓+CO2↑+H2O
MgCO3↓+CO2↑+H2O
C.MgCO3+H2O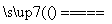 Mg(OH)2↓+CO2↑
Mg(OH)2↓+CO2↑
D.CaCO3+H2O===Ca(OH)2+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为28°(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
(1)该泉水属于________硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂添加顺序为
________,原因是_________________________________________________。
(3)目前常用阴、阳离子交换树脂来进行水的软化,水中的Ca2+、Mg2+与交换
树脂的____________起离子交换作用。当阴离子交换树脂失效后可放入
__________溶液中再生。
(4)岛上还可以用海水淡化来获得淡水。下面是将海水通过电渗析法获得淡水
的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰
性电极。请分析下列问题:
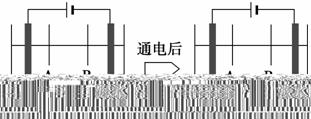
①阳离子交换膜是指__________(填“A”或“B”)。
②写出通电后阳极区的电极反应式:_________________________________;
阴极区的现象是:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中Cl﹣浓度最大的是()
A. 1L 0.1mol•L﹣1的KCl溶液
B. 0.2L 0.1mol•L﹣1的盐酸溶液
C. 0.1L 0.1mol•L﹣1的AlCl3溶液
D. 0.3L 0.1mol•L﹣1的MgCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. HClO4中氯元素化合价比HClO中氯元素化合价高,所以,HClO4的氧化性强
B. 具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应
C. 已知还原性:B﹣>C﹣>D﹣,反应2C﹣+D2=2D﹣+C2和反应 2C﹣+B2=2B﹣+C2都能发生
D. 已知①Fe+Cu2+=Fe2++Cu;②2Fe3++Cu=2Fe2++Cu2+,则氧化性强弱顺序为:Fe3+>Cu2+>Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com