
| A、3 | B、5 | C、7 | D、9 |
|
| 1×10-14 |
| 1×10-9 |


科目:高中化学 来源: 题型:
 液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.下列关于该电池的叙述正确的是( )
液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.下列关于该电池的叙述正确的是( )| A、b极发生氧化反应 |
| B、a极的反应式:N2H4+4OH--4e-=N2↑+4H2O |
| C、放电时,电流从a极经过负载流向b极 |
| D、其中的离子交换膜需选用阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期主族元素.常温下A、B、C的常见单质均为无色、无味的气体,D、E的单质均为固体.C与E同主族,且E的原子序数为C的2倍,D的最外层电子数比最内层多1个,F是人体血红蛋白中含有的一种金属元素,请回答下列问题:
A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期主族元素.常温下A、B、C的常见单质均为无色、无味的气体,D、E的单质均为固体.C与E同主族,且E的原子序数为C的2倍,D的最外层电子数比最内层多1个,F是人体血红蛋白中含有的一种金属元素,请回答下列问题:| T/K | 303 | 313 | 323 |
| BA3生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示的装置中发生反应2A2(g)+B2(g)?2C(g);△H=-a kJ/mol(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向A,B容器中分别充入2mol A2和1mol B2两容器分别在500℃时达平衡,A中C的浓度为w1 mol/L,放出热量b kJ,B中C的浓度为w2 mol/L,放出热量c kJ.请回答下列问题:
如图所示的装置中发生反应2A2(g)+B2(g)?2C(g);△H=-a kJ/mol(a>0),已知P是可自由滑动的活塞.在相同温度时关闭K,向A,B容器中分别充入2mol A2和1mol B2两容器分别在500℃时达平衡,A中C的浓度为w1 mol/L,放出热量b kJ,B中C的浓度为w2 mol/L,放出热量c kJ.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
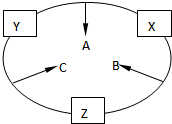 原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.
原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4L水蒸气中含有NA个H2O分子 |
| B、16g 氧气和16g 臭氧含有的电子总数均为8NA |
| C、1 mol乙炔分子中含3NA个碳碳叁键 |
| D、2.3g金属钠与乙醇反应时失去的电子数是0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32- |
| B、肯定存在的离子是SO32-、Br-; Na+、K+离子至少有一种存在 |
| C、无法确定原溶液中是否存在Cl- |
| D、若步骤④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断有影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2++Cl2→Fe3++2Cl- |
| B、2Fe2++2Br-+2I-+3C12→2Fe3++I2+Br2+6Cl- |
| C、2Fe2++4Br-+2I-+4Cl2→2Fe3++I2+2Br2+8Cl- |
| D、4Fe2++2Br-+2I-+4Cl2→4Fe3++I2+Br2+8Cl- |
| E、4Fe2++2Br-+2I-+4Cl2→4Fe3++I2+Br2+8Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com