
| 物质 | CH4 | CH3-CH3 | CH2═CH2 |
| 物质的量分数 | 20% | 30% | 50% |
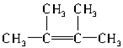 .
. .
. 分析 (1)已知混合气体为2mol,其中乙烯为50%,则乙烯为1mol,根据反应方程式计算消耗的溴;
(2)根据原子守恒计算烃分子中N(C)、N(H),进而确定烃的分子式;根据乙烯的分子结构可知与C=C相连的原子在一个平面内,要保证6个碳原子在一个平面内,则另外4个碳必须直接与C=C相连,由此分析解答.
解答 解:(1)已知混合气体为2mol,其中乙烯为50%,则乙烯为1mol,乙烯与溴反应的方程式为CH2=CH2+Br2→CH2Br-CH2Br,则消耗Br2的物质的量为1mol;
故答案为:1mol;
(2)完全燃烧0.2mol某烃,得到的两种生成物的物质的量均为1.2mol,则生成1.2molCO2和1.2molH2O,
故烃分子中N(C)=$\frac{1.2mol×1}{0.2mol}$=6,N(H)=$\frac{1.2mol×2}{0.2mol}$=12,
①所以该烃的分子式是C6H12,故答案为:C6H12;
②根据乙烯的分子结构可知与C=C相连的原子在一个平面内,要保证6个碳原子在一个平面内,则另外4个碳必须直接与C=C相连,结构简式为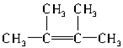 ,故答案为:
,故答案为: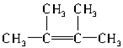 ;
;
③乙烯是平面结构,乙烯中的4个氢原子和2个碳原子共平面,由于有机物可以看做是用4个甲基取代了乙烯中的4个H原子,故此有机物中的这6个碳原子一定共平面,故答案为:6;
④2,3-二甲基-2-丁烯可发生加聚反应,反应方程式为: ,
,
故答案为: .
.
点评 本题考查有机物分子式的确定、同分异构体,题目比较基础,注意掌握燃烧法利用原子守恒确定分子式以及原子共面的判断方法.


科目:高中化学 来源: 题型:选择题
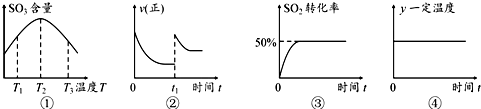
| A. | 由图①可知:该反应的△H>0 | |
| B. | 在图②中的t1时充入少量氩气,容器内压强增大,平衡右移 | |
| C. | 图③所示条件下,平衡常数为2 | |
| D. | 图④中的y可以表示平衡常数或密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气的体积为1.12 L | |
| B. | 原烧碱溶液中含溶质离子0.2NA个 | |
| C. | 所得溶液中含OH-的数目为1×10-5NA | |
| D. | 所得溶液中ClO-的数目为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 基态时,相同周期的两种元素原子所含的能级和能层是一样的 | |
| B. | 基态时,稀有气体元素原子的价层电子数都为8 | |
| C. | 基态时,同种元素的原子和离子的轨道排布式一样 | |
| D. | 非金属元素原子的d轨道一定不填充电子或填满电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类是有甜的有机物 | |
| B. | 糖类物质又叫碳水化合物,因此所有的糖类均可用通式Cn(H2O)m来表示 | |
| C. | 糖类物质和碳水化合物没有实质的联系 | |
| D. | 糖类可以分为单糖和多糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气是氧化产物 | |
| B. | O2F2既是氧化剂又是还原剂 | |
| C. | 若生成4.48 L HF,则转移0.8 mol电子 | |
| D. | 还原剂与氧化剂的物质的量之比为1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙中滴入盐酸 CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | Fe(OH)3 中滴入硫酸 OH-+H +═H2O | |
| C. | AgNO3中滴入NaCl溶液 Ag ++Cl-═AgCl↓ | |
| D. | CO2通入到足量NaOH溶液中CO2+2OH-═CO32-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com