
| ||
| ||
| 2×84g×3.1g |
| 62g |
| 15.9g |
| 106g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、将Na2O2固体投入H218O中:2H218O+2Na2O2=4OH-+4Na++18O2↑ |
| B、1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合:2AlO2-+5 H+═Al(OH)3↓+Al3++H2O |
| C、碳酸氢钠溶液与少量氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| D、硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
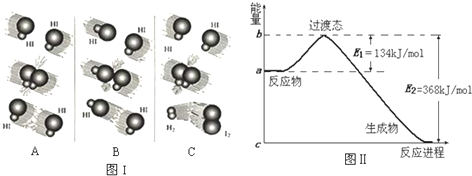
| 化学键 | C-H | Cl-Cl | C-Cl | H-Cl |
| 键能/kJ?mol-1 | X | 243 | 330 | 432 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
| 溶解 |
| ① |
| BaCl2 |
| ② |
| NaOH |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量食盐 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+的3d轨道中有9个电子.
X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+的3d轨道中有9个电子.- 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
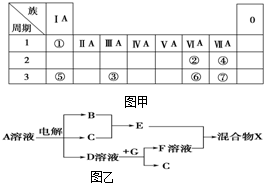 如图甲为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
如图甲为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com