
【题目】下面是实验室制取氨气的装置和选用的试剂,其中错误的是( )
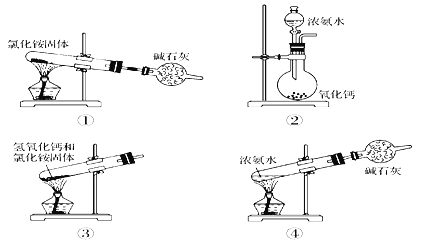
A. ①② B. ②③ C. ③④ D. ①③
【答案】D
【解析】①氯化铵分解产生NH3和HCl,气体在试管口降温后又化合生成NH4Cl甚至会堵塞试管发生危险,所以方案①错误。②浓氨水遇到氧化钙后,溶液中的水与CaO反应生成Ca(OH)2而消耗,反应同时放热使混合物温度升高,得到的Ca(OH)2可以降低NH3在水中的溶解度,这些都会促使氨水挥发生成氨气,因此方案②正确。③2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,但是制备装置的试管口要略向下倾斜,防止水蒸气冷凝回流到试管中使试管炸裂,因此方案③错误。④浓氨水受热分解生成氨气,通过碱石灰吸收水蒸气后可以得到氨气,方案④正确。综上所述,不能制取氨气的是①③,应当选D。
CaCl2+2NH3↑+2H2O,但是制备装置的试管口要略向下倾斜,防止水蒸气冷凝回流到试管中使试管炸裂,因此方案③错误。④浓氨水受热分解生成氨气,通过碱石灰吸收水蒸气后可以得到氨气,方案④正确。综上所述,不能制取氨气的是①③,应当选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )
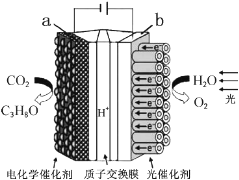
A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1molO2,有44g CO2被还原
D. a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F是一种关节炎止痛药,合成F的一种传统法的路线如下:
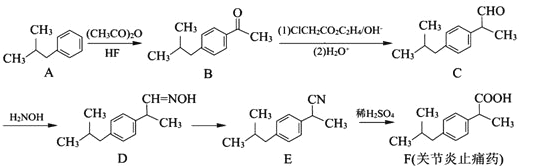
(1)B中含氧官能团的名称为_________。
(2)C→D的反应可分为两步,其反应类型为_________、_________。
(3)写出比F少5个碳原子的同系物X的结构简式:_______________(写一种);X有多种同分异构体,满足下列条件的X的同分异构体共有_______________种。
①属于芳香族化合物;②苯环上只有1个取代基;③属于酯类物质;
(4)写出E转化为F和无机盐的化学方程式:______________________。
(5)已知:①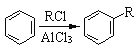
② 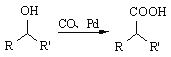 (R1、R2表示烃基)
(R1、R2表示烃基)
合成F的一种改良法是以2—甲基—1—丙醇[(CH3)2CHCH2OH)]、苯、乙酸酐[(CH3CO)2O]为原料来合成,写出有关的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH__________________
CH3CH2OH__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是( )
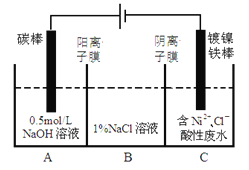
已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A.碳棒上发生的电极反应:4OH— -4e—==O2↑+2H2O
B.电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)催化剂常具有较强的选择性,即专一性。
已知:反应①:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H=-905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=-905.0 kJ·molˉ1
反应②:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H=-1266.6 kJ·molˉ1
2N2(g) +6H2O(g) △H=-1266.6 kJ·molˉ1
写出NO分解生成N2与O2的热化学方程式:______________________________。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应①,测得不同时间的NH3和O2的浓度如下表:
时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
C(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
C(O2)/mol·L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
则下列有关叙述正确的是___________(填选项字母)。
A.使用催化剂,可加快反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
D.前10分钟内的平均反应速率v(NO)=0.088mol·L-1·min-1
II.实验室通常用MnO2作催化剂分解H2O2,已知CuSO4溶液对过氧化氢的分解也具有催化作用,某实验兴趣小组的同学猜想其他盐溶液也可能在这个反应中起同样的作用,于是他们做了以下探究。请你帮助他们完成实验报告:
(1)实验过程:在一支试管中加入5 mL 5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管。
实验现象:__________________________________________________。
实验结论:FeCl3溶液可以催化分解H2O2。
(2)已知FeCl3溶液在水中可解离出Fe3+和Cl-,同学们提出以下猜想:
span> | 促进H2O2分解的微粒 |
甲同学 | H2O |
乙同学 | Fe3+ |
丙同学 | Cl- |
你认为最不可能的是_______同学的猜想,理由是____________________________。
(3)同学们对余下的两个猜想用实验进行了探究,请你仔细分析后完成表格:
实验过程 | 实验现象 | 结论 |
向盛有5 mL 5%的H2O2溶液的试管中滴入少量的 HCl,把带火星的木条伸入试管. | 无明显现象 | _______________ |
向盛有5 mL 5%的H2O2溶液的试管中滴入少量的Fe2(SO4)3,把带火星的木条伸入试管. | _______________ | _______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在人体所需的16种微量元素中有一种被称为生命元素的R元素,对延长人类寿命起着重要的作用。已知R元素的原子有四个电子层,其最高价氧化物分子式为RO3,则R元素的名称
A. 硫 B. 碘 C. 硒 D. 硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、硫的含量影响钢铁性能。某兴趣小组用如下流程对钢样进行探究。

(1)钢样中硫元素以FeS形式存在,FeS在足量氧气中灼烧,生成的固体产物中Fe、O两种元素的质量比为21:8,则该固体产物的化学式为_____________。
(2)检验钢样灼烧生成气体中的CO2,需要的试剂是____________ (填字母)。
a.酸性KMnO4溶液 b.澄清石灰水 c.饱和小苏打溶液 d.浓H2SO4
(3)取10.00 g钢样在足量氧气中充分灼烧,将生成的气体用足量1%的H2O2溶液充分吸收,再用0.1000 mol·L-1NaOH溶液滴定吸收液至终点,消耗NaOH溶液20.00mL;另取10.00g钢样在足量氧气中充分灼烧,将生成的气体通过盛有足量碱石灰的U型管(如下图),碱石灰增重0.614 g。

①用l%H2O2溶液吸收SO2,发生反应的离子方程式为___________________。
②分别计算该钢样中硫、碳元素的质量分数(写出计算过程)。
③实验测得的碳元素质量分数比真实值偏高,其可能的原因是______________(填字母)
a.U型管中生成的亚硫酸盐吸收了O2
b.碱石灰吸收了空气中的CO2
c.气体通过碱石灰的流速过快,末被充分吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用湿法炼锌产生的铜镉渣生产金属镉的流程如下:

已知:铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1 mol·L-1计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Mn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 | 8.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 | 10.6 |
(1)为了提高铜镉渣浸出的速率,可采取的措施有:①适当升高温度;②搅拌;③______等。已知浸出的金属离子均为二价,写出浸出钴的化学方程式__________________。
(2)除钴的过程中,需要加入活化剂Sb2O3,锌粉会与Sb2O3、Co2+的溶液形成微电池并产生合金CoSb。该微电池的正极反应式为________________________________。
(3)除铁的过程分两步进行:
①先加入适量KMnO4,发生反应的离子方程式为______________________________,
②再加入ZnO控制反应液的pH范围为_____________。
(4)除铁过程第①步,若加入KMnO4时条件控制不当,MnO2会继续反应,造成的结果是______________,若加入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证_________________。
(5)净化后的溶液用惰性电极电解可获得镉单质。电解废液中可循环利用的溶质是____。
(6)处理含镉废水常用化学沉淀法,以下是几种镉的难溶化合物的溶度积常数(25℃):
Ksp(CdCO3)=5.210-12, Ksp(CdS)=3.610-29,Ksp(Cd(OH)2)=2.010-16,根据上述信息:
沉淀Cd2+效果最佳的试剂是____________。
a.Na2CO3 b.Na2S c.CaO
若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com