


分析 铝土矿(含30% SiO2、40.8% Al2O3和少量Fe2O3等)加硫酸铵焙烧,Fe2O3转化为NH4Fe(SO4)2同时生成氨气,加水溶解、过滤,滤渣为SiO2和Al2O3,用焦炭在高温条件下还原SiO2、Al2O3得到硅铝熔体,在加纯铝搅拌,得到硅铝合金;
(1)氧化铁是碱性氧化物与酸反应生成铁盐,然后加入KSCN溶液进行检验,观察溶液是否呈血红色;工业上是用碳和二氧化硅在高温条件下反应制备粗硅;
(2)焙烧时尽可能是氧化铁反应,而氧化铝不反应;氨气可以制氮肥,也可以制备硫酸铵循环利用;
(3)根据流程分析解答;溶液中含有铝离子与氢氧根离子生成偏铝酸根离子;
(4)在高温条件下,Al4C3与Al2O3反应生成Al和CO;
(5)铝土矿中含30%SiO2、37.6%Al2O3,又加入27kg纯铝,根据质量守恒计算铝硅的质量和质量比.
解答 解:铝土矿(含30% SiO2、40.8% Al2O3和少量Fe2O3等)加硫酸铵焙烧,Fe2O3转化为NH4Fe(SO4)2同时生成氨气,加水溶解、过滤,滤渣为SiO2和Al2O3,用焦炭在高温条件下还原SiO2、Al2O3得到硅铝熔体,在加纯铝搅拌,得到硅铝合金;
(1)氧化铁是碱性氧化物与酸反应生成铁盐,然后加入KSCN溶液进行检验,观察溶液是否呈血红色,所以检验铝土矿中的铁元素需要试剂:硫酸和KSCN溶液,工业上是用碳和二氧化硅在高温条件下反应制备粗硅,反应的化学方程式为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO+Si,故答案为:硫酸和KSCN溶液;2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO+Si;
(2)焙烧时尽可能是氧化铁反应,而氧化铝不反应,由图可知在300℃时,氧化铁转化为硫酸盐的百分率很高,而氧化铝转化为硫酸盐的百分率最低,所以最适宜焙烧温度为300℃;气体Ⅰ为氨气,氨气可以用于制氮肥,也可以用硫酸吸收来备硫酸铵循环到焙烧过程中;
故答案为:300℃;制氮肥、用硫酸吸收气体(氨气)循环到焙烧过程中;
(4)由流程分析可知,操作①包括:加水溶解、过滤;溶液中含有铝离子与氢氧根离子生成偏铝酸根离子,其反应的离子方程式为:Al3++4OH-=AlO2-+2H2O;
故答案为:过滤;Al3++4OH-=AlO2-+2H2O;
(5)在高温条件下,Al4C3与Al2O3反应生成Al和CO,其反应的方程式为:Al4C3+Al2O3$\frac{\underline{\;高温\;}}{\;}$6Al+3CO↑;
故答案为:Al4C3+Al2O3$\frac{\underline{\;高温\;}}{\;}$6Al+3CO↑;
(6)投入1t铝土矿,加入27kg纯铝,已知铝土矿中含30%SiO2、37.6%Al2O3,则Al的总质量为:1000kg×37.6%×$\frac{54}{102}$+27kg=226kg,
Si的总质量为1000kg×30%×$\frac{28}{60}$=140kg,则铝硅合金中m:n=$\frac{226}{27}$:$\frac{140}{28}$=8:5,
故答案为:8:5.
点评 本题考查了物质分离和提纯基本操作,注意把握流程中发生的化学反应为解答的关键,注重信息与所学知识的结合分析解决问题,侧重知识迁移应用能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 硅与氢氧化钾溶液反应:Si+2OH-+H2O═SiO32-+2H2↑ | |
| B. | Al(OH)3溶于稀硝酸:OH-+H+═H2O | |
| C. | 往氨水中加入少量AlCl3溶液:Al3++4OH-═[Al(OH)4]- | |
| D. | 把水玻璃滴入盐酸中:SiO32-+2H+═H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物稳定性:HF>HCl | B. | 碱性:NaOH>KOH | ||
| C. | 非金属性:P>Cl | D. | 酸性:H2SO4>HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
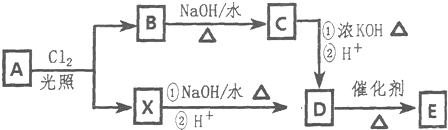
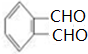
 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$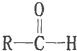

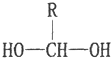
 +4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$
+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$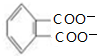 +2NH4++4Ag+6NH3+2H2O
+2NH4++4Ag+6NH3+2H2O .
. .
.
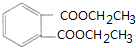 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 | |
| B. | 苯酚能与溴水反应,苯不能与溴水反应 | |
| C. | 甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 甲苯与溴蒸气(光照)发生取代反应,苯与液溴(铁做催化剂)发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B2)=0.8mol(L•s)-1 | B. | v(A2)=0.4 mol(L•s)-1 | ||
| C. | v(C)=0.6 mol(L•s)-1 | D. | v(D)=0.1 mol(L•s)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,图为反应产生氢气速率与反应时间的关系图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com