
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | R一定是共价化合物 | |
| B. | R一定是离子化合物 | |
| C. | R可能是共价化合物,也可能是离子化合物 | |
| D. | R常温下一定是固态物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
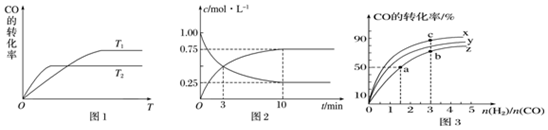
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  如图实验:用托盘天平称量一定质量的氯化钠固体 | |
| B. |  如图实验:配制一定物质的量浓度的硫酸 | |
| C. |  如图实验:用苯萃取溴水中的溴后进行分液 | |
| D. | 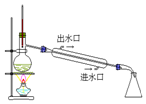 如图实验:用于蒸馏,分离四氯化碳和溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐水、牛奶、豆浆 | B. | 碘酒、泥水、血液 | ||
| C. | 白糖水、食盐水、茶叶水 | D. | Ca(OH)2悬浊液、澄清石灰水、石灰浆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | NaHCO3可用于治疗胃病 | NaHCO3可与盐酸反应 | Ⅰ对,Ⅱ对,无 |
| B | 向滴有酚酞的水溶液中加入Na2O2变红色 | Na2O2与水反应生成氢氧化钠 | Ⅰ对,Ⅱ错,无 |
| C | 金属钠具有强还原性 | 高压钠灯发出透雾性强的黄光 | Ⅰ对,Ⅱ对,有 |
| D | Na2O2可为航天员供氧 | Na2O2能与CO2和H2O反应生成O2 | Ⅰ对,Ⅱ对,有 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
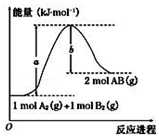
| A. | 每生成 2 个分子 AB 吸收(a-b) kJ 热量 | |
| B. | 该反应热△H=+(a-b)kJ•mol-1 | |
| C. | 逆反应的活化能高于正反应的活化能 | |
| D. | 断裂1mol A-A 和 1mol B-B 键,放出 a kJ 能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com