
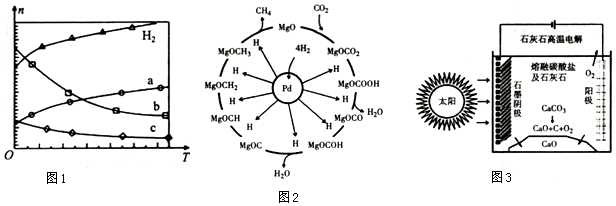
���� ��1���������߱仯��֪�����¶����ߣ����������ʵ��������࣬˵�������¶�ƽ�������ƶ���������Ӧ���ȣ�
��Ϊ���CO2��ƽ��ת���ʣ����ı��¶��⣬���ɲ�ȡ�Ĵ�ʩ������ѹǿ��
��2�����淴Ӧ�ﵽƽ��״̬��һ���������淴Ӧ��������Ҳ�Ϊ�㣬����ֵ�Ũ�Ȳ��ٱ仯���÷�Ӧ���ص�Ϊ��һ�ǿ��淴Ӧ�����Ƿ�Ӧǰ�������������ȣ��ݴ��жϷ�Ӧ�Ƿ�ﵽƽ��״̬��
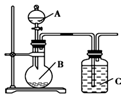
��3��������Ϣ��һ��������Pd-Mg/SiO2������ʹCO2�����黯����Ϸ�Ӧ��������д����ʽ����ϻ��ϼ��жϣ�
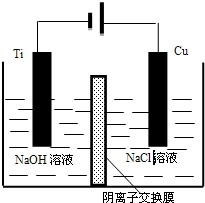
��4������������ԭ��Ӧ����缫��ӦʽΪ3CO2+4e-=C+2CO32-��������̼������ӷ���������Ӧ����缫��ӦʽΪ2CO32--4e-=2CO2��+O2����
��� �⣺��1���������߱仯��֪�����¶����ߣ����������ʵ��������࣬˵�������¶�ƽ�������ƶ���������Ӧ���ȣ�
�ʴ�Ϊ������
��Ϊ���CO2��ƽ��ת���ʣ����ı��¶��⣬���ɲ�ȡ�Ĵ�ʩ������ѹǿ��
�ʴ�Ϊ����ѹ��
��2��A��ͬһ��Ӧ�У��ò�ͬ���ʱ�ʾ������֮�ȵ��ڷ���ʽ����ϵ��֮�ȣ�����v����CO2��=$\frac{1}{2}$v����CH3OH������2v����CH3OH��=v����CO2��������v����CO2����v����CO2������Ӧδ�ﵽƽ��״̬����A����
B��ƽ��ʱCH3OH��H2O�����ʵ���֮�ȱ��ֲ��䣬��Ũ�Ȳ��ٷ����仯������Ϊ�ﵽƽ��ı�־����B��ȷ��
C�����ݦ�=$\frac{m}{V}$��֪����Ӧ�������ﶼ�����壬����mΪ��ֵ����������V���䣬��������Ƿ�ﵽƽ�ⶼ���䣬��C����
D.2CH3OH��g��+CO2 ��g��?CH3OCOOCH3 ��g��+H2O��g������Ӧǰ������ϵ���Ͳ���ȣ�������ѹ���������Ϊ�жϱ�־����D��ȷ��
�ʴ�Ϊ��BD��
��3������Ϣ��һ��������Pd-Mg/SiO2������ʹCO2�����黯��������д������ʽΪ��CO2+4H2=CH4+2H2O����Ӧ������̼Ԫ�صĻ��ϼ�Ϊ-2�۵��м�����MgOCH2��
�ʴ�Ϊ��CO2+4H2=CH4+2H2O��MgOCH2��
��4������������ԭ��Ӧ����缫��ӦʽΪ3CO2+4e-=C+2CO32-��������̼������ӷ���������Ӧ����缫��ӦʽΪ2CO32--4e-=2CO2��+O2����
�ʴ�Ϊ��3CO2+4e-=C+2CO32-��2CO32--4e-=2CO2��+O2����
���� ���⿼��ͼ������������缫����ʽ����д��ƽ���ƶ�Ӱ�����أ�ƽ��״̬���жϣ��������������Ϣ�ǽ����Ĺؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ij�о���ѧϰС�����Ԫ�طǽ�������������������Ӧ��ˮ����֮��Ĺ�ϵ���������ͼװ����һ�������S��C��Si�ķǽ�����ǿ���Ƚϵ�ʵ���о������й����Լ�Bѡ����ȷ���ǣ�������
ij�о���ѧϰС�����Ԫ�طǽ�������������������Ӧ��ˮ����֮��Ĺ�ϵ���������ͼװ����һ�������S��C��Si�ķǽ�����ǿ���Ƚϵ�ʵ���о������й����Լ�Bѡ����ȷ���ǣ�������| A�� | ϡH2SO4 | B�� | Na2SO4��Һ | C�� | Na2CO3��Һ | D�� | Na2SiO3��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCu2O�����ַ�����
����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCu2O�����ַ�����| ����I | ��̼���ڸ��������»�ԭCuO |
| ����II | ���£�N2H4����ԭ����Cu��OH��2 |
| ����III | ��ⷨ����ӦΪ2Cu+H2O$\frac{\underline{\;���\;}}{\;}$Cu2O+H2�� |
| ��� | Cu2O a�� | �¶� | 0 | 10 | 20 | 30 | 40 | 50 |
| �� | ����II | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| �� | ����III | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| �� | ����III | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
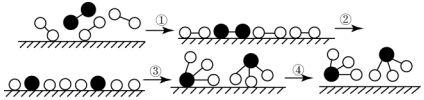
| A�� | �ù��̱������ڻ�ѧ��Ӧ�д��ڻ�ѧ���Ķ������γ� | |
| B�� | �ڴ����������£���Ӧ��Ļ�ѧ����������� | |
| C�� | ���̢����������������̢���ų����� | |
| D�� | �����¸÷�Ӧ���Խ��У�����Ϊ������������Ļ�ѧ�������γ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 1H218O��D216O����Է���������ͬ | |
| B�� | 1H��D����ͬλ�� | |
| C�� | H2O��D2O����ͬ�������� | |
| D�� | 뮣�D��ԭ�Ӻ�����2������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��KI��Һ��ȥFeCl2��Һ�е�Fe3+ | B�� | �ñ���NaHCO3��Һ��ȥCl2�е�HC1 | ||
| C�� | �ý����Ƽ���1һ������2һ���� | D�� | ����ˮ���𱽺ͼ�ϩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
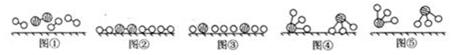
| A�� | �ķ���ʽΪC14H14NO7 | |
| B�� | �ס����и���1������̼ԭ�� | |
| C�� | ����NaHCO3��Һ��FeCl3��Һ������ס��� | |
| D�� | ���������ᡢNaOH��Һ��Ӧ����lmol���������4 mol NaOH��Ӧ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com