
分析 (1)根据n=$\frac{m}{M}$计算出该混合气体的物质的量,然后根据M=$\frac{m}{n}$计算出该混合气体的平均摩尔质量,从而可知该混合气体的平均相对分子质量;
(2)设出混合气体中甲烷、乙烯的物质的量,然后根据平均相对分子质量列式计算.
解答 解:(1)标准状况下11.2L混合气体的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,
该混合气体的平均摩尔质量为:$\frac{9.2g}{0.5mol}$=18.4g/mol,则该混合气体的平均相对分子质量为18.4,
故答案为:18.4;
(2)设混合气体中含有甲烷、乙烯的物质的量分别为x、y,
则:$\frac{16x+28y}{x+y}$=18.4,整理可得:x:y=4:1,
相同条件下,气体的体积分数等于其物质的量分数,则该混合气体中甲烷的体积分数为:$\frac{4}{1+4}$×100%=80%;
混合气体的总物质的量为0.5mol,则乙烯的物质的量为:0.5mol×$\frac{1}{1+4}$=0.1mol,
故答案为:80%;0.1mol.
点评 本题考查了物质的量的相关计算,题目难度中等,明确平均相对分子质量与平均摩尔质量的关系为解答关键,注意熟练掌握物质的量与摩尔质量、气体摩尔体积之间的关系,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 第二周期中,最高价含氧酸酸性最强的是氟 | |
| B. | 碘的非金属性比氯弱 | |
| C. | VA族中原子半径最小的是氮 | |
| D. | 钠的金属性比锂强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 装置Ⅰ在反应过程中自始至终只生成红棕色气体 | |
| B. | 装置Ⅱ开始阶段铁丝只发生析氢腐蚀 | |
| C. | 装置Ⅱ在反应过程中能产生氢气 | |
| D. | 装置Ⅰ在反应结束时溶液中的金属阳离子只有Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
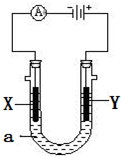 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
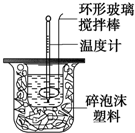 利用如图装置测定中和反应的反应热的实验步骤如下:
利用如图装置测定中和反应的反应热的实验步骤如下:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中所有原子都在同一平面内 | |
| B. | 能与溴水发生加成反应使其褪色 | |
| C. | 能与浓HNO3在一定条件下发生取代反应 | |
| D. | 能与酸性KMnO4溶液反应使其褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com