
【题目】已知X、Y、Z、L、M、N是元素周期表中前20号的六种元素,它们的原子序数依次增大。X和Y可形成常见化合物YX4,一个YX4分子电子总数为10。L原子的最外层电子数是核外电子总数的3/4。NY2加水生成Y2X2和化合物甲。试回答:
(1)X单质和Z单质在一定条件下可生成化合物乙。
①乙的电子式为________________,化学键类型为________________,晶体类型为________________;
②实验室制取乙的化学方程式为_______________________________________。
(2)由M、Y、L三种元素组成的物质焰色反应显浅紫色,向其溶液中滴入酚酞溶液,溶液显红色,原因是__________________________(用离子方程式表示);若再向溶液中滴入过量的氯化钙溶液,观察到的实验现象是_____________________,原因是____________________________________________________________________。
(3)NY2与水反应生成Y2X2和化合物甲的化学方程式为__________________。
【答案】![]() 极性共价键 分子晶体 2NH4Cl + Ca(OH)2
极性共价键 分子晶体 2NH4Cl + Ca(OH)2 ![]() 2NH3↑+ CaCl2 + 2H2O CO32- + H2O
2NH3↑+ CaCl2 + 2H2O CO32- + H2O![]() HCO3- + OH- 生成白色沉淀,且溶液红色褪去 加入过量CaCl2后,发生反应Ca2+ + CO32-=CaCO3↓,CO32-浓度减小,使水解平衡向逆反应方向移动,OH-浓度减小,溶液红色褪去 CaC2 + 2H2O→Ca(OH)2 + C2H2↑
HCO3- + OH- 生成白色沉淀,且溶液红色褪去 加入过量CaCl2后,发生反应Ca2+ + CO32-=CaCO3↓,CO32-浓度减小,使水解平衡向逆反应方向移动,OH-浓度减小,溶液红色褪去 CaC2 + 2H2O→Ca(OH)2 + C2H2↑
【解析】
X、Y、Z、L、M、N是元素周期表中前20号的六种元素,它们的原子序数依次增大。X和Y可形成常见化合物YX4,一个YX4分子电子总数为10,则X为H元素,Y为C元素;L原子的最外层电子数是核外电子总数的3/4,则L为O元素;X、Y、Z原子序数依次增大,则Z为N元素;由于X为H元素,Y为C元素,NY2加水生成Y2X2和化合物甲,Y2X2为C2H2,则NY2为CaC2,化合物甲为Ca(OH)2,N为Ca元素,据此分析解答。
(1)X为H元素,Z为N元素,氢气和氮气反应生成氨气,化合物乙为氨气,则
①氨气为共价化合物,其电子式为![]() ,N原子与H原子间形成极性共价键,氨气的晶体类型为分子晶体;
,N原子与H原子间形成极性共价键,氨气的晶体类型为分子晶体;
②实验室用氢氧化钙固体与氯化铵固体混合加热制取氨气,反应的化学方程式为2NH4Cl + Ca(OH)2![]() 2NH3↑+ CaCl2 + 2H2O;
2NH3↑+ CaCl2 + 2H2O;
(2)Y为C元素,L为O元素,由M、Y、L三种元素组成的物质焰色反应显浅紫色,则M为K元素,则由M、Y、L三种元素组成的物质为K2CO3,由于CO32-水解CO32-+H2O![]() HCO3-+OH-,使溶液显碱性,向其溶液中滴入酚酞溶液,溶液显红色;若再向溶液中滴入过量的氯化钙溶液,由于发生反应Ca2+ + CO32-=CaCO3↓,生成白色沉淀碳酸钙,CO32-浓度减小,使水解平衡向逆反应方向移动,OH-浓度减小,溶液红色褪去;
HCO3-+OH-,使溶液显碱性,向其溶液中滴入酚酞溶液,溶液显红色;若再向溶液中滴入过量的氯化钙溶液,由于发生反应Ca2+ + CO32-=CaCO3↓,生成白色沉淀碳酸钙,CO32-浓度减小,使水解平衡向逆反应方向移动,OH-浓度减小,溶液红色褪去;
(3)由以上分析知,Y2X2为C2H2,NY2为CaC2,化合物甲为Ca(OH)2,CaC2与水反应生成C2H2和Ca(OH)2,反应的化学方程式为CaC2 + 2H2O→Ca(OH)2 + C2H2↑。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】向800mL稀硝酸中加入一定质量的铁粉,铁粉完全溶解后,放出NO气体![]() 标准状况
标准状况![]() ,同时溶液质量增加
,同时溶液质量增加![]() ,下列判断正确的是
,下列判断正确的是![]()
A.原溶液中投入铁粉物质的量是![]()
B.原溶液中的![]() 浓度是
浓度是![]()
C.反应后的溶液中![]() :
:![]() :1
:1
D.反应后的溶液中还可以溶解![]() 铜
铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的叙述正确的是( )
A.糖类、油脂、蛋白质都是有机高分子化合物
B.有机物![]() 可以发生消去反应和催化氧化
可以发生消去反应和催化氧化
C.乙醇可以和金属钠反应很缓慢地放出氢气,说明乙醇的酸性很弱
D.福尔马林可用作食品防腐剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个恒温、恒容的密闭容器中进行下列两个可逆反应:(甲)2X(g) ![]() Y(g)+Z(s) (乙)A(s)+2B(g)
Y(g)+Z(s) (乙)A(s)+2B(g) ![]() C(g)+D(g),当下列物理量不再发生变化时:①混合气体的密度;②反应容器中生成物的百分含量;③反应物的消耗速率与生成物的消耗速率之比等于系数之比;④混合气体的压强⑤混合气体的总物质的量。其中能表明(甲)和(乙)都达到化学平衡状态是( )
C(g)+D(g),当下列物理量不再发生变化时:①混合气体的密度;②反应容器中生成物的百分含量;③反应物的消耗速率与生成物的消耗速率之比等于系数之比;④混合气体的压强⑤混合气体的总物质的量。其中能表明(甲)和(乙)都达到化学平衡状态是( )
A.①②③B.①②③⑤C.①②③④D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 mol N—N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量。根据以上信息和数据,则 N4(g) = 2N2(g)ΔH为( )
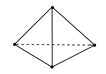
A.+882 kJ·mol-1B.-882kJ·mol-1C.+1216 kJ·mol-1D.-1216 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应类型判断不正确的是( )
A.HOCH2CH2CH2OH![]()
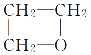 +H2O 消去反应
+H2O 消去反应
B.CH3CH2OH+CuO![]() CH3CHO+Cu+H2O 氧化反应
CH3CHO+Cu+H2O 氧化反应
C.H2C=CHCH=CH2+Cl2![]() CH2ClCH=CHCH2Cl 加成反应
CH2ClCH=CHCH2Cl 加成反应
D.ClCH2CH3+CH3NH2![]() CH3NHCH2CH3+HCl 取代反应
CH3NHCH2CH3+HCl 取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。
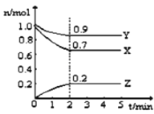
(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2 、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率 v(N2) = __________,250s时,H2的转化率为____________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。![]() 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中___(填“吸收”或“放出”)的能量为____, 反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中___(填“吸收”或“放出”)的能量为____, 反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
(4)反应达平衡时容器内混合气体的平均相对分子质量比起始时____(填增大、减小或不变),混合气体密度比起始时______(填增大、减小或不变)。
(5)为加快反应速率,可以采取的措施是_______
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生活中有广泛应用。
(1)Fe3+基态核外电子排布式为______。
(2)实验室用KSCN溶液、苯酚检验Fe3+。
①1mol苯酚分子中含有σ键的数目为______。
②类卤素离子![]() 可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸
可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸![]() 和异硫氰酸
和异硫氰酸![]() ,这两种酸中沸点较高的是______
,这两种酸中沸点较高的是______
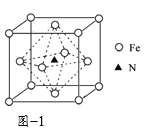
(3)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为______。
(4)某铁的化合物结构简式如图2所示
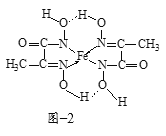
①上述化合物中所含有的非金属元素的电负性由大到小的顺序为______(用元素符号表示)。
②上述化合物中氮原子的杂化方式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH值得盐酸和醋酸溶液分别加水稀释。pH值随溶液体积变化变化如图所示。据图判断正确的是()
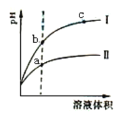
A.Ⅱ为盐酸稀释时pH值变化曲线
B.b点酸的总浓度小于a点酸的总浓度
C.两种酸的物质的量浓度一定相等
D.a点Kw的数值比b点Kw的数值大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com