
分析 (1)①将标准状况下11.2L SO2通入到2L0.5mol•L-1的氨水中,n(SO2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,n(NH3′H2O)=2L×0.5mol•L-1=1mol,n(SO2):n(NH3′H2O)=1:2,反应生成(NH4)2SO3,已知Ka(H2SO3)=1.54×10-2,Ka(HSO3-)=1.02×10-7,Kb(NH3•H2O)=1.77×10-5,可知亚硫酸根离子水解程度大于铵根离子;
②A.(NH4)2SO3溶液中存在物料守恒,n(N)=2n(S);
B.溶液中存在电荷守恒;
C.亚硫酸根离子水解程度大于铵根离子溶液显碱性;
D.依据物料守恒和电荷守恒计算分析;
③常温下,若用1LNaOH溶液吸收0.01mol SO2,完全吸收后溶液中c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),则溶液为NaHSO3,氢氧化钠溶质物质的量为0.01mol;
(2)①平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,固体和纯液体不能写入;
②恒温恒压下,5分钟时,反应到达平衡,气体密度减小16g•L-1,生成S为$\frac{16g}{32g/mol}$/L=0.5mol/L,变化的CO浓度=0.5mol/L×2=1mol/L,反应速率v=$\frac{△c}{△t}$;若升高温度气体的密度增加则平衡逆向进行,逆反应为吸热反应;
③反应是气体体积减少的放热反应,一定条件下在恒容密闭容器中进行上述反应,达到平衡后,下列措施既能提高该反应的速率又能提高SO2的吸收率,依据影响反应速率因素分析升温、加压、增大浓度、加入催化剂都可以增大反应速率,二氧化硫转化率增大,说明平衡正向进行,两种反应物增大一种会提高另一种的转化率;
(3)①SO2与Ba(NO3)2溶液反应生成亚硫酸酸性溶液中形成稀硝酸氧化亚硫酸为硫酸,结合钡离子生成硫酸钡沉淀;
②依据选项中的溶液性质和二氧化硫反应的过程和化学方程式定量关系分析计算.
解答 解:(1)①将标准状况下11.2L SO2通入到2L0.5mol•L-1的氨水中,n(SO2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,n(NH3′H2O)=2L×0.5mol•L-1=1mol,n(SO2):n(NH3′H2O)=1:2,SO2+2NH3′H2O=(NH4)2SO3+H2O,反应生成(NH4)2SO3,已知Ka(H2SO3)=1.54×10-2,Ka(HSO3-)=1.02×10-7,Kb(NH3•H2O)=1.77×10-5,可知亚硫酸根离子水解程度大于铵根离子,溶液显碱性,
故答案为:(NH4)2SO3; 碱;
②A.(NH4)2SO3溶液中存在物料守恒,n(N)=2n(S),[c(NH4+)+c(NH3•H2O)]=2c(SO32-)+2c(HSO3-)+2c(H2SO3),故A错误;
B.溶液中存在电荷守恒,c(NH4+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),故B错误;
C.亚硫酸根离子水解程度大于铵根离子溶液显碱性,溶液中离子浓度大小为:c(NH4+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),故C正确;
D.c(NH4+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),物料守恒:[c(NH4+)+c(NH3•H2O)]=2c(SO32-)+2c(HSO3-)+2c(H2SO3),计算得到:
c(NH3•H2O)+c(OH-)=c(HSO3-)+2c(H2SO3)+c(H+),故D错误;
故答案为:C;
③常温下,若用1LNaOH溶液吸收0.01mol SO2,完全吸收后溶液中c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),则溶液为NaHSO3,氢氧化钠溶质物质的量为0.01mol,氢氧化钠溶质浓度c(NaOH)=$\frac{0.01mol}{1L}$=0.01mol/L,溶液中氢离子浓度c(H+)=$\frac{1{0}^{-14}}{1{0}^{-2}}$=10-12mol/L,PH=12,
故答案为:12;
(2)①SO2(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+S(l),反应的平衡常数K=$\frac{{c}^{2}(C{O}_{2})}{{c}^{2}(CO)c(S{O}_{2})}$,故答案为:$\frac{{c}^{2}(C{O}_{2})}{{c}^{2}(CO)c(S{O}_{2})}$;
②恒温恒压下,5分钟时,反应到达平衡,气体密度减小16g•L-1,生成S为$\frac{16g}{32g/mol}$/L=0.5mol/L,变化的CO浓度=0.5mol/L×2=1mol/L,反应速率v=$\frac{△c}{△t}$=$\frac{1mol/L}{5min}$=0.2mol/(L•min);若升高温度气体的密度增加则平衡逆向进行,逆反应为吸热反应,正反应为放热反应△H<0,
故答案为:0.2mol/(L•min);<;
③SO2(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+S(l),反应为气体体积减少的放热反应,
A.加压反应速率增大,平衡正向进行,二氧化硫吸收率增大,故A正确;
B.增加SO2的浓度反应速率增大,二氧化硫转化率减小,故B错误;
C.升高温度,反应速率增大,平衡逆向进行,故C错误;
D.移走产物平衡正向进行,二氧化硫吸收率增大,反应速率减小,故D错误;
故答案为:A;
(3)①SO2与Ba(NO3)2溶液反应生成亚硫酸酸性溶液中形成稀硝酸氧化亚硫酸为硫酸,结合钡离子生成硫酸钡沉淀,反应的离子方程式为:3SO2+3Ba2++2NO3-+2H2O=2NO+3BaSO4↓+4H+,
故答案为:3SO2+3Ba2++2NO3-+2H2O=2NO+3BaSO4↓+4H+;
②如果用含等物质的量溶质的下列各溶液分别来吸收SO2,
A.H2S 吸收二氧化硫发生的反应为:2H2S+SO2=2H2O+3S↓,1molH2S最多反应二氧化硫0.5mol;
B.Na2SO3 吸收二氧化硫发生的反应为:Na2SO3+SO2+H2O=2NaHSO3,1molNa2SO3 最多吸收二氧化硫1mol;
C.BaCl2 溶液和二氧化硫不反应;
D.酸性KMnO4溶液吸收二氧化硫的反应2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,1molKMnO4最多反应二氧化硫2.5mol;
则吸收二氧化硫理论吸收量由多到少的顺序是DBAC,
故答案为:DBAC.
点评 本题考查了化学反应速率、化学平衡常数、平衡影响因素、氧化还原反应、弱电解质电离平衡等知识点,掌握基础是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | 表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠 | |
| B. | “出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液 | |
| C. | “出汗”→变成白色固体(粉末)过程中只发生物理变化 | |
| D. | 最后变成碳酸钠粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾[KAl(SO4)2•12H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 | |
| B. | 小苏打是制作面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| C. | 浓硫酸可刻蚀石英制艺术品 | |
| D. | 煤经过气化和液化等物理变化可以转化为清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
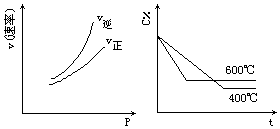 都符合图中两个图象的反应是:(C%表示某反应物的百分含量,v表示反应速率,p表示压强,t表示时间)( )
都符合图中两个图象的反应是:(C%表示某反应物的百分含量,v表示反应速率,p表示压强,t表示时间)( )| A. | N2O3(g)?NO2(g)+NO(g)-Q | B. | 3NO2(g)+H2O(l)?2HNO3 (aq)+NO(g)+Q | ||
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)+Q | D. | CO2(g)+C(s)?2CO(g)-Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
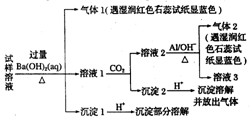 最近一段时间,武邑中学雾霾严重,影响了同学们的生活和健康.雾霾中可能含有如下离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-.高三1490班某同学收集了操场的雾霾,经必要的预处理后得试样溶液,设计并完成了如下实验,根据实验操作与现象,该同学得出的结论不正确的是( )【已知:3NO3-+8Al+5OH-+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$3NH3↑+8AlO2-】
最近一段时间,武邑中学雾霾严重,影响了同学们的生活和健康.雾霾中可能含有如下离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-.高三1490班某同学收集了操场的雾霾,经必要的预处理后得试样溶液,设计并完成了如下实验,根据实验操作与现象,该同学得出的结论不正确的是( )【已知:3NO3-+8Al+5OH-+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$3NH3↑+8AlO2-】| A. | 试样中一定存在的阴离子是SO42-和NO3- | |
| B. | 试样中一定不含Al3+ | |
| C. | 该雾霾中可能存在NaNO3、NH4Cl和MgSO4 | |
| D. | 试样中可能存在Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
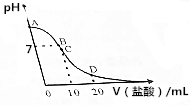 25℃,在20mL0.1mol•L-1氨水溶液中逐滴加入0.2mol•L-1HCl溶液,溶液的pH与所加盐酸的体积关系如图所示,已知0.1mol•L-1氨水的电离度为1.32%.下列说法不正确的是( )
25℃,在20mL0.1mol•L-1氨水溶液中逐滴加入0.2mol•L-1HCl溶液,溶液的pH与所加盐酸的体积关系如图所示,已知0.1mol•L-1氨水的电离度为1.32%.下列说法不正确的是( )| A. | 在A点处的溶液中pH<12 | B. | 在B点:c(NH4+)=c(Cl-)>c(OH-)>c(H+) | ||
| C. | 在C点:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D. | 在D点:c(NH4+)+c(NH3•H2O)=2c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a<b | B. | a>b | C. | a=b | D. | 2b=a |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>X | |
| C. | 最简单氢化物的稳定性:W<Z<X | |
| D. | Y的氧化物不属于两性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com