
下列关于溶液的酸碱性,说法正确的是( )
A.pH=7的溶液是中性
B.中性溶液中一定:c(H+)=1.0×10-7 mol·L-1
C.c(H+)=c(OH-)的溶液呈中性
D.在100°C时,纯水的pH<7,因此显酸性
科目:高中化学 来源:2014年高中化学鲁科版选修四第3章 物质在水溶液中的行为练习卷(解析版) 题型:选择题
下列各组离子在强碱性溶液中,可以大量共存的是( )
A.K+、Na+、HSO 、Cl-
、Cl-
B.Na+、Ba2+、[Al(OH)4]-、NO
C.NH 、K+、Cl-、NO
、K+、Cl-、NO
D.Fe2+、Na+、ClO-、S2-
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:选择题
已知反应
PCl5(g)  PCl3(g)+Cl2(g)①
PCl3(g)+Cl2(g)①
2HI(g)  H2(g)+I2(g) ②
H2(g)+I2(g) ②
2NO2(g) N2O4(g) ③
N2O4(g) ③
在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率( )
A.均不变
B.均增大
C.①增大,②不变,③减少
D.①减少,②不变,③增大
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷(解析版) 题型:选择题
某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:
①5 mL水
②20 mL 0.5 mol·L-1的Na2SO4溶液
③40 mL 0.2 mol·L-1的Ba(OH)2溶液
④40 mL 0.1 mol·L-1的H2SO4溶液中,溶解至饱和
以上各溶液中,c(Ba2+)的大小顺序正确的是( )
A.③>①>④>② B.③>①>②>④
C.①>④>③>② D.①>③>④>②
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷(解析版) 题型:选择题
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
从以上表格中判断以下说明不正确的是( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题2 反应速率与化学平衡练习卷(解析版) 题型:实验题
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计] 控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
实验编号 | 实验目的 | T/K | pH | c/10-3 mol·L-1 | |
H2O2 | Fe2+ | ||||
① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
② | 探究温度对降解反应速率的影响 |
|
|
|
|
③ |
| 298 | 10 | 6.0 | 0.30 |

[数据处理] 实验测得p-CP的浓度随时间变化的关系如上图。
(2)请根据上图实验①曲线,计算降解反应50~150 s内的反应速率:
v(p-CP)=________mol·L-1·s-1。
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:_____________________________
(4)实验③得出的结论是:pH等于10时,________。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:________。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题2 反应速率与化学平衡练习卷(解析版) 题型:选择题
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)  2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.①④
C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题1 化学反应与能量变化练习卷(解析版) 题型:填空题
(1)1.00 L 1.00 mol·L-1 H2SO4溶液与2.00 L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ热量,表示生成1 mol H2O的热化学方程式为_________________________
(2)在25 ℃、101 kPa时,1.00 g C6H6(l)燃烧生成CO2(g)和H2O(l),放出41.8 kJ的热量,C6H6的标准燃烧热为____________kJ·mol-1,该反应的热化学方程式为_______________________________________________
查看答案和解析>>
科目:高中化学 来源:2014年高中化学人教版选修四第二章 化学反应速率与化学平衡练习卷(解析版) 题型:填空题
在一个2 L的密闭容器中,加入3 mol A和1 mol B,发生下述反应:
3A(g)+B(g)??2C(g)+3D(s),5 min达到平衡时,C的浓度为0.6 mol/L。
(1)达到平衡时,A的转化率为 ,此温度下的平衡常数K= 。
(2)维持容器的温度不变,若缩小容器的体积,则平衡将向 (填“正反应方向移动”“逆反应方向移动”或“不移动”)。
(3)维持容器的体积和温度不变,向密闭容器中加入氦气,达到新平衡时,B、C的浓度之比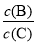 将 (填“增大”、“减小”或“不变”)。
将 (填“增大”、“减小”或“不变”)。
(4)当增加A的浓度,B的转化率 ;若将C分离出来,化学平衡常数 。(填“增大”、“减小”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com