
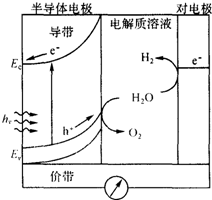
 太阳能发电和阳光分解水制氢气,是清洁能源研究的主攻方向,研究工作之一集中在n-型半导体光电化学电池方面.如图是n-型半导体光电化学电池光解水制氢的基本原理示意图,图中的半导体导带是未充填电子的能级最低的能带,半导体价带是已充填价电子的能级最高的能带,图中的e-为电子、h+为空穴.在光照下,电子(e-)由价带跃迁到导带后,然后流向对电极.下列说法不正确的是( )
太阳能发电和阳光分解水制氢气,是清洁能源研究的主攻方向,研究工作之一集中在n-型半导体光电化学电池方面.如图是n-型半导体光电化学电池光解水制氢的基本原理示意图,图中的半导体导带是未充填电子的能级最低的能带,半导体价带是已充填价电子的能级最高的能带,图中的e-为电子、h+为空穴.在光照下,电子(e-)由价带跃迁到导带后,然后流向对电极.下列说法不正确的是( )| A. | 对电极表面发生的电极反应式为:4H++4e-→2H2 | |
| B. | 电池的总反应式为:2H2O$\stackrel{hv}{→}$O2+2H2↑ | |
| C. | 整个过程中实现了太阳能向电能化学能等的转化 | |
| D. | 装置中电流的方向是从半导体电极流向对电极 |
分析 A.图示分析可知在对电极上发生的反应是水电离出的氢离子得到电子生成氢气;
B.过程是光照分解水生成氢气作为清洁能源;
C.过程分析可知,装置是光能转化为化学能,化学能转化为电能的原电池反应,是光能转化为化学能、电能的转化;
D.依据在光照下,电子(e-)由价带跃迁到导带后,然后流向对电极判断.
解答 解:A.图示分析可知在对电极上发生的反应是水电离出的氢离子得到电子生成氢气电极反应为:4H++4e-→2H2,故A正确;
B.过程是光照分解水生成氢气作为清洁能源,电池的总反应式为:2H2O$\stackrel{hv}{→}$O2+2H2↑,故B正确;
C.过程分析可知,装置是光能转化为化学能,化学能转化为电能的原电池反应,是光能转化为化学能、电能的转化,整个过程中实现了太阳能向电能化学能等的转化,故C正确;
D.在光照下,电子(e-)由价带跃迁到导带后,然后流向对电极,电流方向是对电极流向半导体电极,故D错误;
故选D.
点评 本题考查了能量变化的过程分析,原电池原理、电子流向和电流流向、能量变化的理解应用,掌握基础是解题关键,题目难度中等.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:选择题
化学与能源、环境、生产、生活密切相关。下列说法不正确的是
A.CO2和氟氯烃等物质的大量排放会造成温室效应的加剧
B.可利用工业生产产生的二氧化碳制造全降解塑料
C.世博会很多场馆的外壳使用非晶硅薄膜,以充分利用太阳能,体现低碳经济
D.用K2FeO4代替Cl2处理饮用水,有杀菌消毒作用,且不会形成致癌物,但无净水作用
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46g乙醇中存在的共价键总数为8NA | |
| B. | 0.5 mol•L-1 CuCl2溶液中含有的Cl-个数为NA | |
| C. | 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA | |
| D. | 在反应4Cl2+8NaOH═6NaCl+NaClO+NaClO3+4H2O中,消耗1mol Cl2时转移的电子总数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

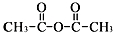
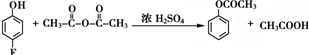 .
.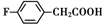 、
、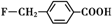
 和乙酸酐为原料制备
和乙酸酐为原料制备 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3COOH$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOCH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3COOH$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOCH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
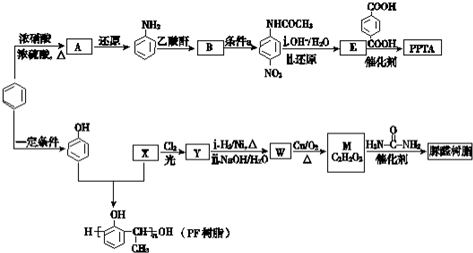
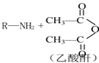 →R-NHCOCH2+CH2COOH(R为烃基)
→R-NHCOCH2+CH2COOH(R为烃基)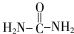 (尿素)氮原子上的氢原子可以像苯酚上的氢原子那样与甲醛发生加成反应,并缩聚成高分子.
(尿素)氮原子上的氢原子可以像苯酚上的氢原子那样与甲醛发生加成反应,并缩聚成高分子.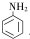 →B 的反应类型是取代反应.
→B 的反应类型是取代反应. .
.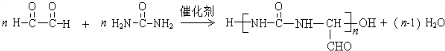 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
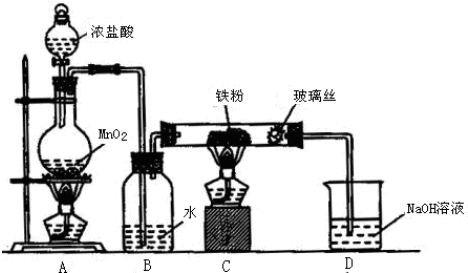
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
下列有关物质的性质与应用相对应的是
A.碳酸钠溶液呈碱性,可用于洗去铁屑表面的油污
B.铝易发生钝化,可用于作飞机、火箭的结构材料
C.炭具有还原性,可用于冶炼钠、镁、铝等金属
D.浓硫酸具有强氧化性,可用于干燥二氧化硫气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com