
(10分)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
|
实验编号 |
反应物 |
催化剂 |
|
① |
10 mL 2% H2O2溶液 |
无 |
|
② |
10 mL 5% H2O2溶液 |
无 |
|
③ |
10 mL 5% H2O2溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
|
④ |
10 mL 5% H2O2溶液+少量HCl溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
|
⑤ |
10 mL 5% H2O2溶液+少量NaOH溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________________________。
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为___________________。
(3)实验①和②的目的是___________________________________________________。
实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是______________________________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。
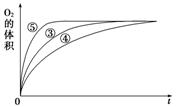
分析上图能够得出的实验结论是_____________________________________________。
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
 (2011?顺德区模拟)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
(2011?顺德区模拟)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol?L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试管 | 温度 | 过氧化氢浓度 | 催化剂 |
| a | 室温(25℃) | 12% | 有 |
| b | 水浴加热(50℃) | 4% | 无 |
| c | 水浴加热(50℃) | 12% | 有 |
| d | 室温(25℃) | 4% | 无 |
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol?L-1FeCl3溶液 |
 O2↑+2H2O
O2↑+2H2O O2↑+2H2O
O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol?L-1FeCl3溶液 |
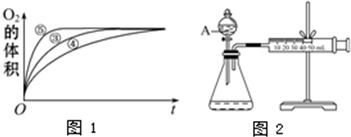
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 无 | |
| ③ | 10mL 5% H2O2溶液 | MnO2 固体 |
| A、5mL 2% H2O2溶液 |
| B、10mL 5% H2O2溶液 |
| C、10mL 2% H2O2溶液 |
| D、5mL 10% H2O2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol?L-1FeCl3溶液 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com