
| A. | 78gNa2O2晶体中所含阴、阳离子个数均为2NA | |
| B. | PCl3和H2O分子中所有原子的最外层都达到8电子稳定结构 | |
| C. | 1.8gD2O含有NA个中子 | |
| D. | 3.4g氨气中含有0.6NA个N-H键 |
分析 A、求出Na2O2的物质的量,然后根据1molNa2O2中含2mol钠离子和1mol过氧根来计算;
B、PCl3分子中所有原子的最外层都达到8电子稳定结构;H2O分子中H原子的最外层电子数为2;
C、重水的摩尔质量为20g/mol;
D、求出氨气的物质的量,然后根据1mol氨气中含3molN-H键来分析.
解答 解:A、78gNa2O2的物质的量为1mol,而1molNa2O2中含2mol钠离子和1mol过氧根,故含有的阴阳离子的物质的量为3mol,个数为3NA,故A错误;
B、PCl3分子中所有原子的最外层都达到8电子稳定结构;H2O分子中H原子的最外层电子数为2,故B错误;
C、重水的摩尔质量为20g/mol,故1.8g重水的物质的量为0.09mol,而1mol重水中含10mol中子,故0.09mol重水中含0.9mol中子,故C错误;
D、3.4g氨气的物质的量为0.2mol,而1mol氨气中含3molN-H键,故0.2mol氨气中含0.6molN-H键,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:多选题
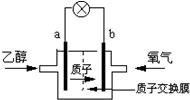
| A. | a极为电池的负极,乙醇被还原 | |
| B. | 电池工作时电子由b极沿导线经灯泡再到a极 | |
| C. | 电池正极的电极反应为:2H++O2+4e-=H2O | |
| D. | 电池工作时1mol乙醇被氧化时,就有12mol质子通过质子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧红的木炭和热的浓硫酸 | B. | 铜和浓硫酸共热 | ||
| C. | 食盐和浓硫酸共热 | D. | 蔗糖中滴入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
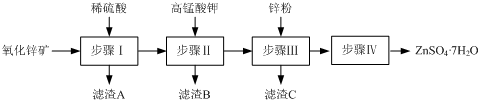
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. ,结构式为H-O-H.
,结构式为H-O-H.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
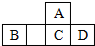 四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中C元素原子核外电子总数是其最外层电子数的3倍.下列有关判断正确的是( )
四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中C元素原子核外电子总数是其最外层电子数的3倍.下列有关判断正确的是( )| A. | 简单氢化物的热稳定性:C>A | |
| B. | 最高价氧化物对应水化物的酸性:D<C | |
| C. | B的最高价氧化物的水化物能与D的最高价氧化物的水化物反应 | |
| D. | 常温下它们的单质均为固态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4,C2H4,C3H6任意体积比 | |
| B. | CH4,C3H6,C2H2保持C3H6:C2H2=1:2(物质的量之比) | |
| C. | C2H6,C4H6,C2H2同条件下体积比为2:1:2 | |
| D. | C3H8,C4H8,C2H2质量比为11:14:26 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
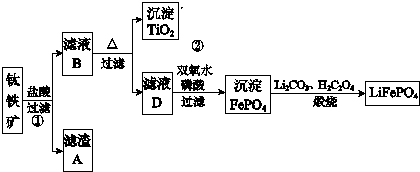
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com