
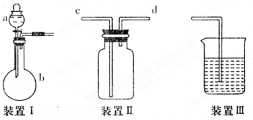
 某实验小组利用如图所示装置完成有关实验.
某实验小组利用如图所示装置完成有关实验.

科目:高中化学 来源: 题型:
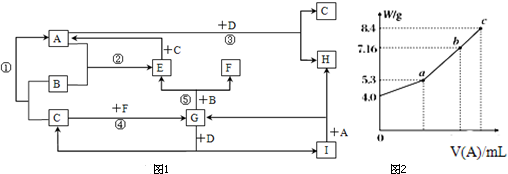
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学习小组用乙醇与氢溴酸为原料制备溴乙烷.该反应发生的原理为:C2H5OH+HBr
某学习小组用乙醇与氢溴酸为原料制备溴乙烷.该反应发生的原理为:C2H5OH+HBr| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 |
| 3 |
| A、22.2% |
| B、27.5% |
| C、33.3% |
| D、36.8% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能I(eV) | A | B | C | D | E |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 153.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com