
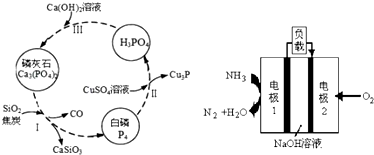
分析 ①依据发生反应2Ca3(PO4)2+6SiO2+10C→P4↑+6CaSiO3+10CO↑,判断CO的作用;
②根据图知,该反应中Cu元素化合价由+2价变为+1价、P元素化合价由0价变为-3价和+5价,根据转移电子守恒进行计算.
解答 解:①步骤Ⅰ为白磷的工业生产方法之一,发生反应2Ca3(PO4)2+6SiO2+10C→P4↑+6CaSiO3+10CO↑,反应中C中的碳化合价升高,做还原剂;
故答案为:做还原剂;
②Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,若有11molP4参加反应,其中5mol的P4做氧化剂,60mol硫酸铜做氧化剂,只有6mol的P4做还原剂,则由电子守恒可知,有1 mol的CuSO4参加反应,则被硫酸铜氧化的白磷分子的物质的量为n则:n×4×(5-0)=1mol×(2-1),解得n=0.05mol;
故答案为:0.05mol.
点评 本题考查氧化还原反应的有关计算,为高频考点,侧重考查学生分析计算能力,注意白磷和硫酸铜反应中白磷既作氧化剂又作还原剂,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 燃放烟花爆竹 | B. | 为城市主干道洒水保洁 | ||
| C. | 大面积开发土建项目 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在1L密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在1L密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol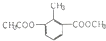 能与4molNaOH充分反应 能与4molNaOH充分反应 | |
| B. |  系统命名法为3-丁烯 系统命名法为3-丁烯 | |
| C. |  的碳原子都在一个平面内,且它的二氯代物为3种 的碳原子都在一个平面内,且它的二氯代物为3种 | |
| D. | 1mol 可以与4molH2发生加成 可以与4molH2发生加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
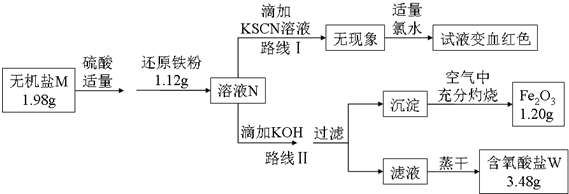
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
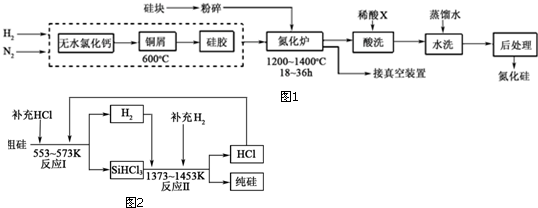
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的PH | 4.79 | 4.62 | 4.55 | 4.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com