
已知某KOH样品中含水7.62%,含K2CO32.23%,含KOH90%.现将1.00g样品加入46.00mL1.00mol/L的盐酸中,过量的酸用1.070mol/LKOH溶液刚好中和.蒸发溶液,蒸发到无水时,可得到固体的质量约为( )
|
| A. | 3.00g | B. | 3.43g | C. | 4.50g | D. | 无法计算 |
考点:
有关混合物反应的计算.
专题:
守恒法.
分析:
根据Cl元素守恒计算,最后固体产物为KCl,物质的量应为0.046L×1.00mol/L=0.046mol,以此计算最后固体的质量.
解答:
解:K2CO3和KOH与盐酸反应的产物都是KCl,盐酸过量,用1.070mol/LKOH溶液刚好中和,最后全部生成KCl,
即蒸发得到的固体为KCl,根据Cl元素守恒可得:
n(KCl)=n(HCl)=0.046L×1.00mol/L=0.046mol,
所以m(KCl)=0.046mol×74.5g/mol=3.43g.
故选B.
点评:
本题考查物质的质量计算,题目难度不大,本题利用Cl元素守恒计算.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
下列说法正确的是()
A. 可利用过滤的方法区别溶液和胶体
B. 制备Fe(OH)3胶体通常是将Fe(OH)3固体溶于沸水
C. 直径介于1nm~100nm之间的微粒称为胶体
D. 电泳现象证明胶体粒子是带电的
查看答案和解析>>
科目:高中化学 来源: 题型:
在锌与某浓度的盐酸起反应的实验中,一个学生得到下面的结果:
序号 锌的质量/g 锌的形状 温度/℃ 完全溶解于酸的时间/s
A 2 薄片 5 400
B 2 薄片 15 200
C 2 薄片 25 100
D 2 薄片 30 t1
E 2 薄片 35 50
F 2 颗粒 15 t2
G 2 粉末 15 t3
则下列说法正确的是()
①t1=75s ②t2>200>t3 ③单位时间内消耗的锌的质量mG>mF>mB.
A. ① B. ①② C. 只有② D. 全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中:①配制一定物质的量浓度的溶液;②pH试纸的使用;③过滤;④蒸发,均可用到的仪器是( )
|
| A. | 试管 | B. | 漏斗 | C. | 胶头滴管 | D. | 玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度、压强下,向100mLCH4和Ar的混合气体中通入400mLO2,点燃使其完全燃烧,最后在相同条件下得到干燥气体460mL,则反应前混合气体中CH4和Ar物质的量之比是( )
|
| A. | 1:4 | B. | 1:3 | C. | 1:2 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)实验室制取Cl2的化学方程式为 .
(2)工业上电解饱和食盐水制取氯气,该反应的化学方程式为 .在接电源 (填“正”或“负”)极的电极上可以收集到Cl2.
查看答案和解析>>
科目:高中化学 来源: 题型:
在一种酸性溶液中可能存在Fe3+、NO3﹣、Cl﹣、I﹣中的一种或几种,向该溶液中加入溴水,再加入淀粉,溶液变蓝.由此可推断溶液中()
A. 一定含有I﹣,不能确定是否含有Cl﹣
B. 可能含有NO3﹣、Cl﹣和I﹣
C. 可能含有NO3﹣
D. 一定含有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
图1为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线.试回答:
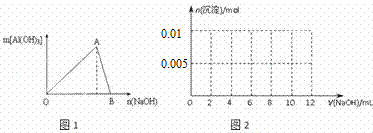
Ⅰ.A点时已参加反应的AlCl3和NaOH的物质的量之比为1比 ;
Ⅱ.B处溶液中存在的浓度最大的离子是 (填离子符号);向B处生成的溶液中通入过量的二氧化碳,可见到的现象是(用离子方程式来表示) ;
Ⅲ.铝铵矾是一种复盐,其主要化学成分为十二水硫酸铝铵NH4Al(SO4)2.12H2O,向该盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化,已知NH4+与AlO2﹣在水溶液中不能大量共存,会发生如下反应:
NH4++AlO2﹣+H2O=Al(OH)3↓+NH3↑.试回答:
(1)写出硫酸铝铵在水溶液中电离的方程式: ;
(2)在逐滴加入NaOH溶液的过程中,产生的现象有:
①溶液中出现白色沉淀;②有刺激性气味的气体放出;③白色沉淀量逐渐增多;④白色沉淀完全消失:⑤白色沉淀逐渐减少.请排出以上各种现象由先到后出现的正确顺序(用序号答) ;
(3)向含有0.1mol NH4Al(SO4)2溶液中逐滴加入5mol•L﹣1NaOH溶液,请在图2中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com