
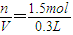 =5mol/L
=5mol/L

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:必修二高手化学苏教版 苏教版 题型:022
由铜片、锌片和300 mL稀硫酸组成的原电池中,当铜片上放出3.36 L气体(标准状况)时,硫酸恰好用完,生成这些气体消耗锌________g,有________个电子通过了导线,原稀硫酸的物质的量浓度为________mol·L-1.
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com