
分析 (1)根据碳酸钙中加入100ml稀盐酸(过量),反应方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑,根据生成二氧化碳的体积计算消耗碳酸钙的质量;
(2)根据碳酸钙计算氯化钙的物质的量,再根据C=$\frac{n}{V}$计算浓度.
解答 解:(1)根据碳酸钙中加入100ml稀盐酸(过量),反应方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑,
碳原子守恒得CaCO3----CO2,设碳酸钙的质量为x,
CaCO3----CO2
100g 22.4L
x 1.12L
100g:22.4L=x:1.12L
解得x=5g,
答:碳酸钙的质量为5g;
(2)根据钙原子守恒得CaCO3----CaCl2,氯化钙的物质的量=$\frac{5.0g}{100g}$=0.05mol,氯化钙的物质的量浓度=$\frac{0.05mol}{0.1L}$=0.5mol/L,
答:所得溶液中氯化钙的物质的量浓度为0.5mol/L.
点评 本题考查了物质的量的有关计算,根据溶液中物质之间的关系式进行计算,难度不大.


科目:高中化学 来源: 题型:解答题
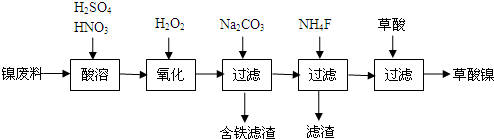
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器的总压强不随时间而变化 | |
| B. | 容器内气体的密度不再改变 | |
| C. | 单位时间内有nmolA2生成的同时有nmolB2消耗 | |
| D. | v正(A2)=2v逆(AB) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
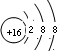 .X与Y形成的离子化合物的电子式为
.X与Y形成的离子化合物的电子式为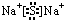 ,Z和Y的最高价氧化物对应的水化物反应的离子方程式为H++OH-=H2O.
,Z和Y的最高价氧化物对应的水化物反应的离子方程式为H++OH-=H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与硫酸的反应OH-+H+=H2O | |
| B. | 铝粉投入到NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500℃时比室温更有利于合成氨的反应 | |
| B. | 红棕色的NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往加入过量的空气 | |
| D. | 实验室中常用排饱和食盐水的方法收集氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
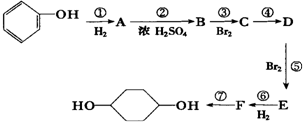 已知实验室由
已知实验室由 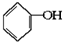 合成
合成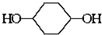 的反应流程如下 (部分试剂和反应条件已略去) (X代表卤素原子,R代表烃基)
的反应流程如下 (部分试剂和反应条件已略去) (X代表卤素原子,R代表烃基) 、D
、D
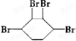
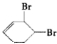 、
、
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
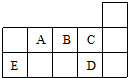
| A. | ED4分子中各原子均达8电子结构 | |
| B. | AD3和ED4两分子的中心原子均为sp3杂化 | |
| C. | A、B、C第一电离能的大小顺序为C>B>A | |
| D. | C、D气态氢化物稳定性强弱和沸点高低均为C>D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com