
| A. | Fe3+、NH4+、SCN-、Cl- | B. | Na+、Mg2+、NO3-、SO42- | ||
| C. | Al3+、Fe2+、NO3-、Cl- | D. | K+、Na+、Cl-、SiO32- |
科目:高中化学 来源: 题型:选择题
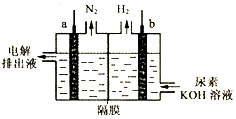
| A. | 电极b与外电源的负极相连 | |
| B. | 电解时,OH-、尿素分子均可穿过隔膜进入左室 | |
| C. | a极反应式为:CO(NH2)2-6e-+H2O═CO2↑+N2↑+6H+ | |
| D. | 每消耗1g尿素则产生标准状况下1.12LH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
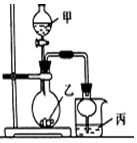 利用图所示装置进行下列实验,其中丙中实验现象描述正确的是( )
利用图所示装置进行下列实验,其中丙中实验现象描述正确的是( )| 实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
| A | 70%硫酸 | Na2SO3 | 紫色石蕊试液 | 溶液先变红后褪色 |
| B | 浓盐酸 | KMnO4 | 含酚酞的NaOH溶液 | 溶液褪色 |
| C | 稀盐酸 | CaCO3 | BaCl2溶液 | 有白色沉淀生成 |
| D | 浓氨水 | CaO | AlCl3溶液 | 先生成白色沉淀然后沉淀溶解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 g H2的分子数为NA | |
| B. | 标准状况下,22.4 L H2O含有NA个水分子 | |
| C. | 7.8 g过氧化钠与足量水反应转移的电子数为0.2NA | |
| D. | 1 mol/L Mg(NO3)2溶液中含有NO3-的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气极易溶解于水且溶解的快,因此可用来做喷泉实验 | |
| B. | 实验室可用氢氧化钠溶液处理含有二氧化硫或氯气的尾气 | |
| C. | 铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉通风处 | |
| D. | 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
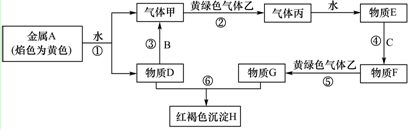
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
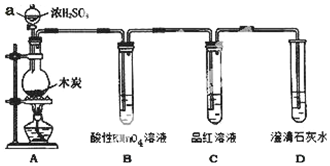 为了探究木炭与浓H2SO4反应的产物中是否存在CO2,某同学选用如图所示装置进行实验:
为了探究木炭与浓H2SO4反应的产物中是否存在CO2,某同学选用如图所示装置进行实验: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠的还原性很强,只能以化合态存在于自然界 | |
| B. | 钠质地柔软,可用小刀切割,保存在煤油中 | |
| C. | 钠失火后可用大量水或泡沫灭火器扑灭 | |
| D. | 钠的焰色反应为黄色,可用在雾天做指示灯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com