
【题目】氨气(NH3)是一种重要的化工原料,广泛应用于制氮肥、制药、合成纤维等。请回答下列问题:
(1)2molNH3在标准状况下的体积是___。
(2)2molNH3的质量是___,其中所含氢元素的质量是___。
(3)2molNH3所含的氨分子数为___,电子数为___。
(4)工业上用反应N2+3H2 ![]() 2NH3来合成氨气,则若制得2molNH3,标准状况下参与反应的H2的体积为___;14克N2参与反应可得NH3物质的量为___。
2NH3来合成氨气,则若制得2molNH3,标准状况下参与反应的H2的体积为___;14克N2参与反应可得NH3物质的量为___。
【答案】44.8L 34g 6g 2NA或1.204×1024 20NA或1.204×1025 67.2L 1mol
【解析】
(1)利用V=n×Vm计算;
(2)利用m=n×M计算;
(3)利用N=n×NA计算;
(4)化学计量数之比等于物质的量之比。
(1)标准状况下的气体摩尔体积为22.4L/mol,V=n×Vm=2mol×22.4L/mol=44.8L;
(2)m=nM=2mol×17g/mol=34g;一个氨气分子中含有3个氢原子,则氢原子的物质的量为6mol,质量为6g;
(3)N=n×NA=2mol×NAmol-1=2NA;一个氨气分子中含有10个电子,则电子数为分子数的10倍,即20NA;
(4)化学计量数之比等于物质的量之比,若制得2molNH3,需要氢气的物质的量为3mol,标况下的体积为67.2L;14克N2即0.5mol,可制取NH3物质的量为1mol。


科目:高中化学 来源: 题型:
【题目】在反应3Cu +8HNO3(稀) == 3Cu(NO3)2 + 2NO↑ +4H2O 中
(1)用单线桥标出电子转移___________________________
(2)还原剂是__________,被还原的元素是__________,还原产物是__________。
(3)若生成2mol的NO气体,溶液中生成的Cu2+为___________mol。
(4)在反应中硝酸显示_________性和____________性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定有机化合物中碳和氢的组成常用燃烧分析法,下图是德国化学家李比希测定有机物组成的装置,氧化铜作催化剂,在750℃左右使有机物在氧气流中全部氧化为CO2和H2O,用含有固体氢氧化钠和氯化钙的吸收管分别吸收CO2和H2O。

试回答下列问题:
(1)甲装置中盛放的是________,甲、乙中的吸收剂能否颠倒?________。
(2)实验开始时,要先通入氧气一会儿,然后再加热,为什么? _____________________。
(3)将4.6 g有机物A进行实验,测得生成5.4 g H2O和8.8 g CO2,则该物质中各元素的原子个数比是________。
(4)经测定,有机物A的核磁共振氢谱图显示有三组峰,则A的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
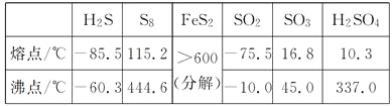
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为____________________________,基态S原子电子占据最高能级的电子云轮廓图为________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________________。
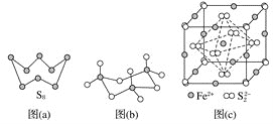
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为anm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______________________________g·cm-3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为________nm。
所形成的正八面体的体心,该正八面体的边长为________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、SO42-)中回收氧化铁流程如下:

已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生的离子反应方程式:___________,指出使用空气的优点是:_________。
(2)已知Fe3+(aq)+3OH-(aq)===Fe(OH)3(s)ΔH=-Q1kJ·mol-1,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=_________。
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上下列微粒在该溶液中可存在的最大浓度c(Fe3+)=___________,c(Mg2+)=___________。
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时Fe(OH)3沉淀中可能混有的杂质是______ (填化学式,下同),用_______试剂可将其除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石经处理后得到明矾( KAl(SO4)2·12H2O)。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
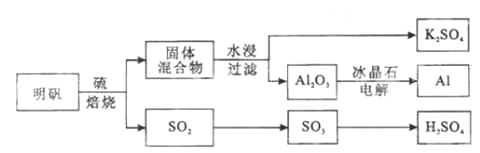
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是__________________。
(2)从水浸后的滤液中得到K2SO4晶体的方法是_____________________。
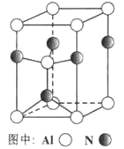
(3)A12O3在一定条件下可制得AIN,其晶体结构如右图所示,该晶体中Al的配位数是____。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是_____________________________。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g)![]() 2SO3(g) △H1= 一197 kJ/mol;
2SO3(g) △H1= 一197 kJ/mol;
2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是__________________________。
焙烧948t明矾(M=474 g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠(NaCl)是生活中常用的化学品,也是重要的化工生产原料。
(1)某同学用含钠元素的不同类别物质制备NaCl。请再列举3种反应:
①2Na+Cl2![]() 2NaCl
2NaCl
②___;
③___;
④___。
(2)粗盐中一般含有CaCl2、MgCl2、CaSO4和MgSO4杂质。从粗盐制得精盐的过程如下:

①写出MgCl2、CaSO4的电离方程式:___、___。
②各操作分别是:操作a___、操作b___、操作c___。
③试剂Ⅰ是___。
④加入试剂Ⅱ所发生的离子方程式为___,加入试剂Ⅲ所发生的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制Cl2的反应为4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O.下列说法错误的是( )
MnCl2+Cl2↑+2H2O.下列说法错误的是( )
A. 还原剂是HCl,氧化剂是MnO2
B. 每生成1 molCl2,转移电子的物质的量为2 mol
C. 每消耗1 molMnO2,起还原剂作用的HCl消耗4mol
D. 生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com