
【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+ Y(g)![]() 2Z(g) △H<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A. 该温度下此反应的平衡常数K = 1.44
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 反应前2 min的平均速率v(Z) = 2.0×10-3 mol/(L·min)
D. 其他条件不变,再充入0.2 mol X,平衡时Y的体积分数增大
【答案】A
【解析】
A项,由表可知7min时,反应已经平衡,Y的物质的量为0.1mol,此时X的物质的量也为0.1mol,则可得Z的物质的量为0.12mol,物质的量浓度分别为0.01mol/L、0.01mol/L、0.012mol/L,平衡常数为K=![]() =
=![]() =1.44,故A项正确;
=1.44,故A项正确;
B项,该反应的正反应是放热反应,降低温度平衡正向移动,则反应达到新平衡之前v(逆)<v(正),故B项错误;
C项,由表可得前2min内生成Z为0.08mol,则v(Z) =![]() =4.0×10-3 mol/(L·min),故C项错误;
=4.0×10-3 mol/(L·min),故C项错误;
D项,其他条件不变,再充入0.2 mol X,平衡正向移动,Y的转化率增大,则Y的体积分数减小,故D项错误。
综上所述,本题正确答案为A。


科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3的说法正确的是( )
A.在水中溶解度:Na2CO3<NaHCO3
B.二者都能与盐酸反应生成CO2
C.热稳定性:Na2CO3<NaHCO3
D.二者在相同条件下可相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭烧瓶中,25 ℃时存在着平衡:2NO2(g)![]() N2O4(g)(正反应放热)。把烧瓶置于100 ℃的水中,则下列几项性质中不会改变的是
N2O4(g)(正反应放热)。把烧瓶置于100 ℃的水中,则下列几项性质中不会改变的是
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度
A. ①和③ B. ②和④ C. ④和⑤ D. ③和⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同的A、B密闭容器中分别充入2 mol SO2和1 mol O2,使它们在一定温度下反应,并达新平衡:2SO2+O2![]() 2SO3(g)。若A容器保持体积不变,B容器保持压强不变。当A中SO2的转化率为25%时,B中SO2的转化率为
2SO3(g)。若A容器保持体积不变,B容器保持压强不变。当A中SO2的转化率为25%时,B中SO2的转化率为
A. 25%B. 大于25%
C. 小于25%D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可利用如下反应将二氧化碳转化为甲烷:CO2(g)+2H2O(g) ![]() CH4(g)+2O2(g) ΔH=+802KJ/mol,下图为在恒温、光照、不同初始浓度和不同催化剂(Ⅰ、Ⅱ)作用下,体积为2L的莫比容器中n(CH4)随光照时间的变化曲线。下列说法正确的是
CH4(g)+2O2(g) ΔH=+802KJ/mol,下图为在恒温、光照、不同初始浓度和不同催化剂(Ⅰ、Ⅱ)作用下,体积为2L的莫比容器中n(CH4)随光照时间的变化曲线。下列说法正确的是
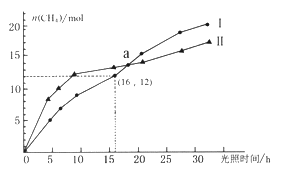
A. 0-15h内,催化剂Ⅱ的催化效果比催化剂Ⅰ效果好
B. 反应开始后的30h内,第Ⅰ种催化剂的作用下,反应吸收的热量多
C. a点时,CO2的转化率相等
D. 0-16h内,v(O2)=1.5mol/(L·h)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:CH4(g)+4NO2( g)=4NO(g)+CO2(g)+2H2O(g) △H= -574 kJ·mol-l;CH4(g)+4NO(g)=2N2 (g)+CO2 (g)+2H2O(g) △H=-1160 kJ·mol-1,该条件下CH4(g)还原NO2(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式:__________。
(2)已知在448 ℃时,反应H2(g)+I2(g) ![]() 2HI(g)的平衡常数K1为49,则该温度下反应反应
2HI(g)的平衡常数K1为49,则该温度下反应反应![]() H2(g)+
H2(g)+![]() I2(g)
I2(g) ![]() HI(g)的平衡常数K3为___________________________。
HI(g)的平衡常数K3为___________________________。
(3)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①)该反应的化学平衡常数表达式为K=________。
②该反应为________(填“吸热”或“放热”)反应。
③能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(CO)不变 C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
④某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________ ℃。
⑤在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2 mol·L-1,c(H2)为1.5 mol·L-1,c(CO)为1 mol·L-1,c(H2O)为3 mol·L-1,则下一时刻,反应将________(填“正向”或“逆向”)进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氮是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的氨氮(用NH3表示)转化为氮气除去,相关反应如下:
① NH3 +HClO===NH2Cl+H2O ② NH2Cl+HClO===NHCl2+H2O ③ 2NHCl2 +H2O===N2+HClO+3HCl
已知在水溶液中NH2Cl较稳定,NHCl2不稳定易转化为氮气。在其他条件一定的情况下,改变![]() (即NaClO溶液的投入量),溶液中次氯酸钠去除氨氮效果与余氯(溶液中+1价氯元素的含量)影响如右图所示。则下列说法正确的是
(即NaClO溶液的投入量),溶液中次氯酸钠去除氨氮效果与余氯(溶液中+1价氯元素的含量)影响如右图所示。则下列说法正确的是

A. 次氯酸与氨的总反应可表示为:2NH3+3HClO===N2+3H2O+3HCl
B. 反应中氨氮去除效果最佳的n(NaClO)/n(NH3)值约为1.5
C. a点之前溶液中发生的主要反应为:NH2Cl+HClO===NHCl2+H2O
D. 次氯酸钠溶液pH较小时有O2生成,促使氨氮去除率提高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照物质的组成和性质来分类,CaO属于
①化合物 ②混合物 ③金属氧化物 ④非金属氧化物 ⑤酸性氧化物 ⑥碱性氧化物
A.②④B.①④⑤C.①③⑥D.②③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com