
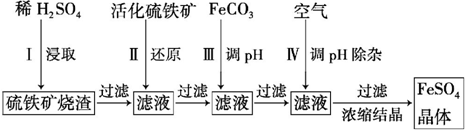
���� �����������������ȡ�����˺���Һ�к�����������δ��Ӧ�����ᣬ�û������ԭFe3+����ˣ�����Һ�м���FeCO3������ҺpH�����˺���ͨ�������������ҺpH����ȥ��Һ���������ӣ�����Ũ���ᾧ�õ�FeSO4���壬
��1��H2SO4��Fe2O3��Ӧ������������ˮ��
��2����KSCN ��Һ����ڢ���Fe3+�Ƿ���ȫ��ԭ��
��3���������Խ�������������Ϊ�����ӣ�������ˮ��ʹ��ҺpH���ͣ�
��4��������Ӧ��4FeCO3+O2$\frac{\underline{\;\;��\;\;}}{\;}$2Fe2O3+4CO2�����ݸ�˹���ɣ�����֪�Ȼ�ѧ����ʽ�����ʵ���ϵ�����мӼ�������Ŀ���Ȼ�ѧ����ʽ��
��5����طŵ�ʱ���ܷ�ӦΪ��4Li+FeS2�TFe+2Li2S������������ԭ��Ӧ��FeS2��õ�������Fe��S2-��
��6���ڢ�Ӧ����FeCO3��ȡʱ��������ᡢ�������ԭFe3+ʱ���ɵ�������ȫת��ΪFeSO4������FeS2��7Fe2��S04��3��7Fe2O3����μӷ�Ӧ��FeS2�����ʵ�����������Ԫ���غ����n����FeSO4������FeԪ���غ����n��FeCO3�����ٸ���m=nM������������
��� �⣺�����������������ȡ�����˺���Һ�к�����������δ��Ӧ�����ᣬ�û������ԭFe3+����ˣ�����Һ�м���FeCO3������ҺpH�����˺���ͨ�������������ҺpH����ȥ��Һ���������ӣ�����Ũ���ᾧ�õ�FeSO4���壮
��1��H2SO4��Fe2O3��Ӧ������������ˮ����Ӧ���ӷ���ʽΪ��Fe2O3+6H+=2Fe3++3H2O���ʴ�Ϊ��Fe2O3+6H+=2Fe3++3H2O��
��2��KMnO4��Һ��K3[Fe��CN��6]��Һ���Լ�����Fe2+���ɣ�ȡ�ڢ�Ӧ����Һ�������Թ��У��μ�KSCN ��Һ������Һ�����ɫ��˵��Fe3+��ȫ����ԭ��
�ʴ�Ϊ��C��
��3���������Խ�Fe2+��������ΪFe3+���ӣ�Fe3+����ˮ������H+��ʹ��ҺpH���ͣ�
�ʴ�Ϊ���������Խ�Fe2+��������ΪFe3+���ӣ�Fe3+����ˮ������H+��
��4��������Ӧ��4FeCO3+O2$\frac{\underline{\;\;��\;\;}}{\;}$2Fe2O3+4CO2��
��֪����4Fe��s��+3O2��g���T2Fe2O3��s����H=-1648kJ/mol
��C��s��+O2��g���TCO2��g����H=-393kJ/mol
��2Fe��s��+2C��s��+3O2��g���T2FeCO3��s����H=-1480kJ/mol
���ݸ�˹���ɣ���-�ۡ�2+�ڡ��ܿɵ�4FeCO3��s��+O2��g��=2Fe2O3��s��+4CO2��g�����ʡ�H=-1648kJ/mol-2����-1480kJ/mol��+4����-393kJ/mol��=-260kJ/mol��
�ʷ�Ӧ�Ȼ�ѧ����ʽΪ��4FeCO3��s��+O2��g��=2Fe2O3��s��+4CO2��g����H=-260kJ/mol��
�ʴ�Ϊ��4FeCO3��s��+O2��g��=2Fe2O3��s��+4CO2��g����H=-260kJ/mol��
��5����طŵ�ʱ���ܷ�ӦΪ��4Li+FeS2�TFe+2Li2S������������ԭ��Ӧ��FeS2��õ�������Fe��S2-�������缫��ӦʽΪ��FeS2+4e-=Fe+2S2-��
�ʴ�Ϊ��FeS2+4e-=Fe+2S2-��
��6��Fe2O3����Ϊ50%��ckg�����У�Fe2O3����Ϊ50%��ckg�����Ľ�ȡ��Ϊ96%����μӷ�Ӧ��Fe2O3����Ϊ50%��ckg��96%�������ʵ���Ϊ��50%��c��103��96%��g��160g/mol=3c mol��
akg��������Ϊb%��������m��H2SO4��=b%��akg�������ʵ���Ϊ��b%��a��103��g��98g/mol=$\frac{10ab}{98}$mol��
�ڢ�Ӧ����FeCO3��ȡʱ��������ᡢ�������ԭFe3+ʱ���ɵ�������ȫת��ΪFeSO4��
����FeS2��7Fe2��S04��3��7Fe2O3����֪�μӷ�Ӧ��FeS2�����ʵ���$\frac{1}{7}$��3c mol��
������Ԫ���غ����n����FeSO4��=$\frac{1}{7}$��3c mol��2+$\frac{10ab}{98}$mol��
��FeԪ���غ�n��FeCO3��=n����FeSO4��-n��FeS2��-2n��Fe2O3��=$\frac{1}{7}$��3c mol��2+$\frac{10ab}{98}$mol-$\frac{1}{7}$��3c mol-2��3c mol=$\frac{10ab}{98}$mol-$\frac{39c}{7}$mol����m��FeCO3��=��$\frac{10ab}{98}$-$\frac{39c}{7}$�� mol��116g/mol�֣�11.8ab-646c��g����Ϊ��0.0118ab-0.646c��Kg��
�ʴ�Ϊ����0.0118ab-0.646c����
���� ���⿼�����ʷ�����ᴿ�������Ʊ���Ϊ��Ƶ���㣬���ؿ������ӷ���ʽ��д�����Ӽ��顢�Ȼ�ѧ����ʽ��д���缫��Ӧʽ����ѧ����ȣ���6���м���Ϊ�״��㡢�ѵ㣬ע�������غ㷨���㣬������㷱������Ŀ�Ѷ��еȣ�


 ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
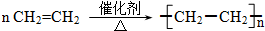 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | ���� | C�� | ���� | D�� | ���ж� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��������������ѧ��Fulvio Cacace���˻���˼��������о������N4���ӣ� N4���ӽṹ��ͼ����֪����1mol N-N����167kJ����������1molN��N���ų�942kJ����������������Ϣ�����ݣ�����N2��������1mol��̬N4�ġ�HΪ��������
��������������ѧ��Fulvio Cacace���˻���˼��������о������N4���ӣ� N4���ӽṹ��ͼ����֪����1mol N-N����167kJ����������1molN��N���ų�942kJ����������������Ϣ�����ݣ�����N2��������1mol��̬N4�ġ�HΪ��������| A�� | +882 kJ/mol | B�� | +441 kJ/mol | C�� | -882 kJ/mol | D�� | -441 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 13C��14C����ͬһ��Ԫ�أ����ǻ�Ϊͬλ�� | |
| B�� | 28g��ϩ�͵����Ļ�������к���NA��������� | |
| C�� | �������������п�飬�ɼ�������ĸ�ʴ | |
| D�� | �����£�1mol•L-1�� Na2CO3��Һ����������������2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ���� | ���� | ���� |
| A | ���հ�ɫ��ĩ��ֱ�ӹ۲������ɫ | ����ʻ�ɫ | ԭ��ĩ����Na+��K+ |
| B | ��һ��Al���ھƾ��ƻ��������� | Al�����ڶ������� | Al2O3���нϸߵ��۵� |
| C | ��һС��Na��������ͭ��Һ�� | ��ͭ�������� | Na���û�������ͭ�е�ͭ |
| D | ��ˮ����ͨ�����ȵ����� | ��ĩ��� | ����ˮ�ڸ����·�����Ӧ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

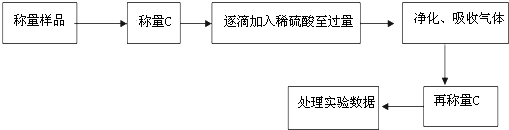
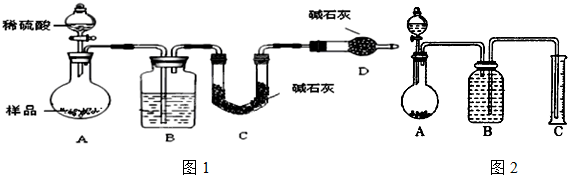
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ư���ǻ�����Ч�ɷ���CaCl2 | |
| B�� | ������ˮ�������ݳ�����������Cl2 | |
| C�� | Cl2��ʹʪ�����ɫ������ɫ��˵��Cl2����Ư���� | |
| D�� | ʵ�����ö���������Ũ���ᷴӦ��ȡCl2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com