
【题目】下列说法:① CH3CH=CHCH3分子存在顺反异构现象;② CH≡CCH3中最多有5个原子共线;③ CH2Cl2有两种结构;④ 苯乙烯分子中最多有16个原子共平面。其中正确的是
A. ①④ B. ②③ C. ②④ D. ③④
 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】只用一种试剂可区别Na2SO4 、MgCl2 、FeCl2 、Al2(SO4)3 、(NH4)2SO4 五种溶液,这种试剂是 ( )
A. Ba(OH)2 B. H2SO4 C. NaOH D. AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同一短周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示。则下列说法正确的是

A. 气态氢化物的稳定性:M>N
B. Z的最高价氧化物能溶于稀氨水
C. X和W形成的常见化合物中阴、阳离子个数比为2:1
D. Z和R的简单离子半径:Z3+<R-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①N2(g)+O2(g)===2NO(g) ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g) ![]() 2NH3(g) ΔH2=-92.4 kJ·mol-1
2NH3(g) ΔH2=-92.4 kJ·mol-1
③2H2(g)+O2(g)===2H2O(g) ΔH3=-483.6 kJ·mol-1
下列说法正确的是 ( )
A. 反应②中的能量变化如图所示:

则ΔH2=E1-E3
B. H2的燃烧热为241.8 kJ·mol-1
C. 氨的催化氧化反应为4NH3(g)+5O2(g)===4NO(g)+ 6H2O(g) ΔH=+906 kJ·mol-1
D. 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,最终反应放出的热量小于92.4 kJ,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠、碳酸氢钠是日常生产生活中常用的两种盐。在实验室中制取NaHCO3的方法有多种。请
依据下列方法回答问题:
方法一:模拟工业“侯氏制碱法”制取:(原理NaCl+H2O+CO2+NH3 = NaHCO3↓+NH4Cl)
第一步:连接好装置,检验气密性,在仪器内装人药品。
第二步:让某一装置先发生反应,直到产生的气体不能再在Ⅲ中溶解,再通入另一装置中产生的气体,片刻后,Ⅲ中出现固体。继续向Ⅲ中通入两种气体,直到不再有固体产生。
第三步:分离Ⅲ中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。

(1)图中所示装置的连接顺序是:a接f;e接________;b接_________(填接口编号)。
(2)I中盛放稀盐酸的仪器名称是_____________,IV中应选用的液体为________________。
(3)第二步中让_____________ (填序号)装置先发生反应。
(4)第四步中所加固体粉末为________。所得的晶体中常含有少置的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4Cl。简要写出操作和现象______________________。
方法二:把CO2通人饱和Na2CO3溶液制取NaHCO3。装置如下图所示(气密性已检验,部分夹持装置略):

(5)请结合化学平衡移动原理解释B中溶液的作用_________________。
(6)当C中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用。为确定固体的成分,实验小组设计方案如下(取一定量的固体,配成溶液作为样液,其余固体备用):
①方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀。
实验小组对现象产生的原理进行分析,认为该方案不合理,理由是________________。
②方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生。
实验小组认为固体中存在NaHCO3,其离子方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以A和B为原料合成扁桃酸衍生物F的路线如下:

(1)A的分子式为C2H2O3,可发生银镜反应,且具有酸性,A所含官能团的名称为_________。写出A+B![]() C的反应类型:_________。
C的反应类型:_________。
(2) 中①、②、③三个-OH与钠反应活性由强到弱的顺序是_____。
中①、②、③三个-OH与钠反应活性由强到弱的顺序是_____。
(3)E是由2分子C生成的含有3个六元环的化合物,E分子核磁共振氢谱峰面积之比_______。
(4)D![]() F的反应方程式是______________,1molF在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为____________mol,符合下列条件的F的所有同分异构体有四种(不考虑立体异构),写出其中两种的结构简式:___________。
F的反应方程式是______________,1molF在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为____________mol,符合下列条件的F的所有同分异构体有四种(不考虑立体异构),写出其中两种的结构简式:___________。
①属于一元酸类化合物 ②苯环上只有2个取代基且处于对位,其中一个是羟基
(5)已知: ,下列流程是A的一种合成方法___________,写出方框中各物质的结构简式:
,下列流程是A的一种合成方法___________,写出方框中各物质的结构简式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)我省拥有非常丰富的海洋资源,合理开发利用海洋资源,造福海南人民。
①目前国际上“海水淡化”的主要方法有______________________ (任写一种);
②我省著名的莺歌海盐场是重要的海水晒盐基地。海水晒盐的原理是海水受热使水分 _________ ,当NaCl达到其饱和浓度时,以固态形式析出;
③海水经过处理后获得的饱和食盐水可以通过_________ 法制得NaOH、Cl2和H2等重要的化工原料;
④从氯碱工业的副产品中能够得到一种含氯消毒剂,有效成分为NaClO,该消毒剂起作用的原理是利用了NaClO的__________(填“强氧化性”或“强还原性”)。
(2)合成氨是重要的化学工业之一,其部分生产工艺如下图所示

请回答下列问题:
①操作Ⅰ的名称是______。
a.蒸馏 b.过滤 c.干馏
②合成氨反应中催化剂的主要作用是________________________ ;
③从合成塔中出来的气体除了NH3之外,还有_________________ (写化学式);
④合成氨工业中,操作Ⅱ的工艺称为“循环操作”,使用该工艺的好处是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图回答问题:
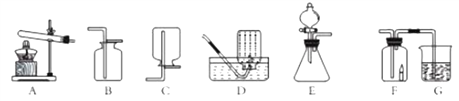
(1)实验中制取氨气的原理是_____________(填化学方稈式),制取装置是_____________(填序号)。
(2)小勤和小华都用连接好的装置E、F、G做实验,他们在E中所加的药品不同,在G 中所加药品相同。小勤在实验过程中发现F中的蜡烛熄灭,G中的溶液变浑浊,则E中分液漏斗和锥形瓶中盛放的药品分别是_________(填名称);小华在实验过程中发现F中的蜡烛燃烧更旺,G中的溶液也变浑浊,则E中反应的化学方程式为_____________________。
(3)小明取走装置F中的蜡烛后,想用它收集H2,然而没有达到目的,经检査装置气密性良好,药品量也充足,那么可能的原因是___________,要进行的改进操作是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于四种基本反应类型的是( )
A. CuSO4+H2S===CuS↓+H2SO4
B. 2FeCl3+Cu===2FeCl2+CuCl2
C. Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
D. 4Fe(OH)2+O2+2H2O===4Fe(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com