
| A. | 0.01 mol•L-1HA的溶液中c(H+)=1×10-4mol•L-1 | |
| B. | pH=3的HA溶液与pH=11的NaOH溶液等体积混合后所得溶液中c(Na+)>c(A-)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1 mol•L-1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,则 c(OH-)-c(H+)<c(HA)-c(A-) | |
| D. | pH=3的HA溶液与pH=11的NaOH溶液按体积比1:10混合后所得溶液中 c(OH-)+c(A-)═c(H+)+c(Na+) |
分析 根据溶液中c(OH-)与c(H+)的比值结合溶液的离子积常数Kw计算出溶液的c(H+),判断出酸的强弱性质,再根据与碱反应的性质判断反应后溶液的pH,进而判断反应后溶液中离子浓度的大小比较.
A、依据$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-8和水的离子积Kw=1×10-14,计算得到酸溶液中的氢离子浓度为c(H+)=0.001mol/L;
B、HA为弱酸,NaOH为强碱,氢离子浓度与氢氧根离子浓度相同时,HA的浓度比NaOH大;
C、浓度均为0.1 mol•L-1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,说明HA的电离程度大于酸根离子水解程度;
D、任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
解答 解:A、溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-8,Kw=c(H+)•c(OH-)=1×10-14,两式中的氢离子浓度是溶液中酸电离出的,氢氧根离子浓度是水电离出的,联立解得c(H+)=0.001mol/L,故A错误;
B、相同体积的PH=3的HA溶液与PH=11的NaOH溶液中HA的物质的量比NaOH多,混合后溶液显酸性,离子浓度大小顺序应为c(A-)>c(Na+)>c(H+)>c(OH-),故B错误;
C、浓度均为0.1 mol•L-1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,说明HA的电离程度大于酸根离子水解程度,溶液中存在电荷守恒c(OH-)+c(A-)=c(H+)+c(Na+),存在物料守恒2c(Na+)=c(HA)+c(A-),c(OH-)-c(H+)=c(Na+)-c(A-)=$\frac{c({A}^{-})+c(HA)}{2}$-c(A-)=$\frac{c(HA)-c({A}^{-})}{2}$>c(HA)-c(A-),
c(HA)-c(A-)为负值,故C错误;
D、任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(OH-)+c(A-)=c(H+)+c(Na+),故D正确;
故选D.
点评 本题考查了弱电解质的电离,根据氢离子浓度和氢氧根离子浓度的关系确定酸的强弱,再根据溶液中的溶质及其性质确定溶液酸碱性、离子浓度大小,注意守恒思想的灵活运用,题目难度中等.


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:选择题
据报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程如下图所示。下列说法中不正确的是 ( )

A.状态I→状态Ⅲ是放热过程
B.该过程中,CO没有断键形成C和O
C.状态I→状态Ⅲ表示CO和O生成了CO2
D.状态I→状态Ⅲ表示CO与O2反应的过程
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 缺少限制条件,无法测定 | B. | H+离子浓度相同 | ||
| C. | 温度低时,H+离子浓度大 | D. | 温度高时,H+离子浓度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10 | 0.5 | 20.6 |
| 第二次 | 10 | 4.2 | 24.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
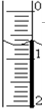 某学生用NaOH标准溶液滴定未知浓度的盐酸,进项了如下实验:
某学生用NaOH标准溶液滴定未知浓度的盐酸,进项了如下实验:| 实验次数 | 待测盐酸体积(mL) | 标准氢氧化钠溶液体积(mL) | ||
| 初读数 | 末读数 | 消耗体积 | ||
| 1 | 15.00 | 0.50 | 17.75 | 17.25 |
| 2 | 15.00 | 0.05 | 16.10 | 16.05 |
| 3 | 15.00 | 0.00 | 15.95 | 15.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HBr、CO2、H2O、CS2 | B. | Cl2、Na2S、HCl、SO2 | ||
| C. | NaCl、HCl、H2O、NaOH | D. | Na2O2、H2O2、H2O、O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com