
| ||
| 10min |
| 2mol |
| 4mol |


科目:高中化学 来源: 题型:
| A、氯水和SO2使品红溶液褪色及SO2可使酸性高锰酸钾溶液褪色的原理不同 |
| B、向某溶液中加入氯化钡溶液生成白色沉淀,再加稀硝酸,白色沉淀不消失该原溶液一定含有SO42- |
| C、用KSCN溶液鉴别FeCl2溶液、FeCl3溶液 |
| D、用氢氟酸雕刻玻璃,是由于氢氟酸能与二氧化硅反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
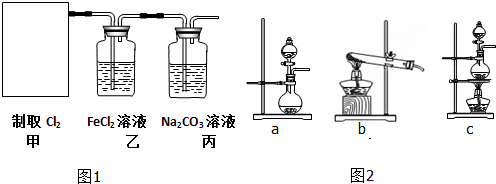
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组对电化学问题进行了实验探究.利用如图装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生.
某化学兴趣小组对电化学问题进行了实验探究.利用如图装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生.查看答案和解析>>
科目:高中化学 来源: 题型:
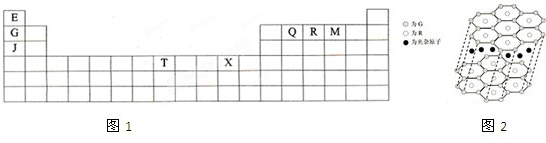
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com