
| A. | 浓硫酸有吸水性 | |
| B. | 盐酸有挥发性 | |
| C. | 气态溶质的溶解度随温度开高而降低 | |
| D. | 浓硫酸有脱水性 |
分析 根据题干中的条件和现象,浓硫酸滴入盐酸中 会有白雾生成,说明浓硫酸溶于水时溶液温度升高,是因为浓硫酸会吸收水放热,溶液中的氯化氢易挥发为气体,遇到水蒸气形成白雾,气体的溶解度随温度升高减小.
解答 解:A、浓硫酸的吸水性是指吸收现成的水分子,包括水蒸汽、湿存水和结晶水.吸收过程中放出热量,是水合的过程,属于导致产生该现象的原因,故A不选;
B、白雾生成是溶液温度 升高,氯化氢变为气体挥发出去,和水蒸气形成盐酸小液滴,证明盐酸具有挥发性,属于导致产生该现象的原因,故B不选;
C、从氯化氢气体的挥发可以说明气体溶解度随温度升高,故C不选;
D、浓硫酸的脱水性是指浓硫酸把有机物的H、O两元素按原子个数比2:1的比例脱出来,形成水分子.不属于导致产生该现象的原因,故D选;
故选D.
点评 本题考查了浓硫酸的性质应用,盐酸溶液的性质,气体溶解度的影响因素等,主要是理解浓硫酸的脱水性、吸水性的实质和应用.


科目:高中化学 来源: 题型:解答题
 美国已计划将甲醇燃料电池用于军事.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解质中直接加入纯化后的甲醇,同时向一个电极通入空气.
美国已计划将甲醇燃料电池用于军事.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解质中直接加入纯化后的甲醇,同时向一个电极通入空气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气中用瓷坩埚煅烧钠制取过氧化钠 | |
| B. | 采用蒸馏的方法分离碘的四氯化碳溶液 | |
| C. | 氯气通入溴化铁溶液,比较氯和溴的活泼性 | |
| D. | H2S气体通入CuSO4溶液,比较氢硫酸和硫酸的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| B. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦提取青蒿素的过程中发生了化学变化 | |
| C. | “静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol-NH2(氨基)中所含有的电子数为0.9NA | |
| B. | lmol D218O所含的中子数为12NA | |
| C. | 14 g聚乙烯与聚丙烯的混合物中含H原子的数目为2NA | |
| D. | 一定条件下,0.2 mol SO2与足量O2充分反应,生成的SO3分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇的结构简式:C2H6O | |
| B. | 氯化氢的电子式: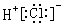 | |
| C. | 镁原子结构示意图: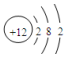 | |
| D. | 氢氧化钠的电离方程式:NaOH═Na++O2-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 )是制备氯丁橡胶的原料,由于碳碳双键上的氢原子很难发生取代反应,因此它不能通过1,3-丁二烯与Cl2直接反应,如图是2-氯-1,3-丁二烯的合成路线:
)是制备氯丁橡胶的原料,由于碳碳双键上的氢原子很难发生取代反应,因此它不能通过1,3-丁二烯与Cl2直接反应,如图是2-氯-1,3-丁二烯的合成路线:
 结构不稳定
结构不稳定 制备氯丁橡胶的化学方程式:
制备氯丁橡胶的化学方程式: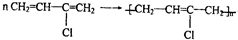 .该反应属于加聚反应(填写反应类型)
.该反应属于加聚反应(填写反应类型)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氟元素是电负性最大的非金属元素,且氟原子的半径小,因此氟单质极易和金属单质反应且把它们氧化到最高价态,如MnF7、VF5、CaF2等.氟元素还可以和氧元素形成氟化物,如OF2等.
氟元素是电负性最大的非金属元素,且氟原子的半径小,因此氟单质极易和金属单质反应且把它们氧化到最高价态,如MnF7、VF5、CaF2等.氟元素还可以和氧元素形成氟化物,如OF2等.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com