
【题目】将10.8g表面被氧化的金属钠投入到足量的水中得到溶液200mL,并生成2.24L的气体(标准状况下)。往得到的溶液中通入一定量的CO2气体,充分反应后将溶液低温蒸干,得到固体27.4g。求:
(1)原金属中单质钠的质量分数(保留一位小数)___;
(2)所得200mL溶液的物质的量浓度___;
(3)通入的CO2在标准状况下的体积___。
【答案】42.6% 2mol/L 6.72L
【解析】
根据2Na+2H+=2Na++H2↑,生成2.24L(标况下)氢气,即0.1mol,需要Na的物质的量为0.2mol,m(Na)=0.2×23=4.6g;则表面的氧化物的质量=10.8-4.6=6.2g,氧化物为氧化钠时,n(Na2O)=![]() =0.1mol,溶于水后生成0.2molNaOH,与Na生成NaOH,合计0.4mol。
=0.1mol,溶于水后生成0.2molNaOH,与Na生成NaOH,合计0.4mol。
(1)分析可知,未被氧化的Na的质量为4.6g,则质量分数=![]() ×100%=42.6%;
×100%=42.6%;
(2)生成NaOH的物质的量为0.4mol,溶液的体积为200mL,即0.2L,c(NaOH)=![]() =2mol/L;
=2mol/L;
(3)若0.4molNaOH全部生成NaHCO3时,得到固体的质量33.6g;若全部为Na2CO3时,得到固体的质量为21.2g,现得到27.4g,则固体为NaHCO3与Na2CO3混合物;
根据Na守恒:n(NaHCO3)+2n(Na2CO3)=0.4mol,根据质量守恒,n(NaHCO3)×84+n(Na2CO3)×106=27.4g,解二元一次方程组,n(Na2CO3)=0.1mol,n(NaHCO3)=0.2mol,根据C守恒,则通入的二氧化碳的物质的量为0.3mol,标况下的体积为6.72L。


科目:高中化学 来源: 题型:
【题目】平衡:2NO2(g)![]() N2O4(g) ΔH<0。在测定NO2的相对分子质量时,下列条件中较为适宜的是( )
N2O4(g) ΔH<0。在测定NO2的相对分子质量时,下列条件中较为适宜的是( )
A.温度130℃,压强3.03×105PaB.温度25℃,压强1.01×105Pa
C.温度130℃,压强5.05×104PaD.温度0℃,压强5.05×104Pa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为__________洪特规则内容_____________
泡利不相容原理内容______________________
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)__________I1(Cu)(填“大于”或“小于”)。原因是__________
(3)ZnF2具有较高的熔点(872℃ ),其化学键类型是__________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是__________
(4)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为__________,配位数为____六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为__________g·cm-3(列出计算式)。
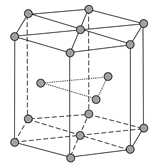
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲烷的结构式是______乙烯的电子式是______将6.72L(标准状况)乙烯和甲烷的混合气通入足量的溴水中,充分反应后,溴水的质量增加了4g,原混合气体中乙烯和甲烷的物质的量之比是______
(2)在烷烃分子中,每增加一个碳原子,1mol烷烃完全燃烧需要多消耗氧气(填字母)______
A.1mol B.1.5mol C.2mol D.2.5mol
(3)乙醇分子内有四种不同的化学键(如图) ,在不同的化学反应中会断裂不同的化学键,请写出下列反应的化学方程式,并指出反应时乙醇分子中断裂的化学键
,在不同的化学反应中会断裂不同的化学键,请写出下列反应的化学方程式,并指出反应时乙醇分子中断裂的化学键
A.乙醇在Cu催化下发生氧化反应:_________________,断裂(填序号)___化学键;
B.乙醇中投入钠粒冒气泡:_____________,断裂(填序号)___化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列模型并结合有关信息,判断下列说法不正确的是( )
晶体硼(其每个结构单元中有12个B原子) | NaCl | S8 | HCN | |
结构模型示意图 |
|
|
|
|
备注 | 熔点2573K | —— | 易溶于CS2 | —— |
A.晶体硼属于原子晶体,结构单元中含有30个B-B键,含20个正三角形
B.NaCl晶体中每个Na+周围距离最近且相等的Na+有6个
C.S8分子中的共价键为非极性键
D.HCN分子中含有2个σ键,2个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质]A、B、C、D、E五种元素是周期表中前四周期的元素。只有A、B、C为金属且同周期,原子序数A<B<C。A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道。D原子最外层电子数是其周期序数的三倍。E能与D形成化合物ED2,可用于自来水的消毒。
(1)C的基态原子的价层电子排布式为_____;D和E的电负性大小关系为____(用元素符号表示)。
(2)化合物E2D分子的空间构型为____________________,中心原子采用_____________杂化。E与D还可形成三角锥结构的阴离子,该离子的化学式为_______,任意写出一种它的等电子体的化学式为____________。
(3)B与E能形成一种化合物BE4,其熔点:-25℃,沸点:l 36.4℃。则该化合物属于____晶体,晶体内含有的作用力类型有__________。
(4)A、B、D三种元素形成的某晶体的晶胞结构如图,则晶体的化学式为______。若最近的B与D的原子距离为a cm,该物质的摩尔质量为M g/mol,阿伏加德罗常数的数值为NA,则该晶体的密度为_________g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知反应:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) △H=-99kJ·mol-1,在V2O5存在时的反应机理为:①V2O5+SO2→V2O4·SO3(快),②V2O4·SO3+
SO3(g) △H=-99kJ·mol-1,在V2O5存在时的反应机理为:①V2O5+SO2→V2O4·SO3(快),②V2O4·SO3+![]() O2→V2O5+SO3(慢)。下列说法错误的是
O2→V2O5+SO3(慢)。下列说法错误的是
A.对总反应的速率起决定性的是反应②
B.将1molSO2(g)、0.5molO2(g)置于密闭容器中充分反应,放出热量99kJ
C.V2O4·SO3是该反应的中间产物,它与O2的碰撞仅部分有效
D.V2O5是该反应的催化剂,加V2O5可提高单位时间内SO2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩拜单车可利用车篮处的太阳能电池板向智能锁中的锂离子电池充电,电池反应原理为:LiCoO2+6C![]() Li1-xCoO2+LixC6,结构如图所示,下列说法错误的是
Li1-xCoO2+LixC6,结构如图所示,下列说法错误的是
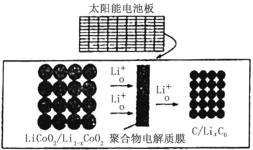
A.充电时,阴极质量增加,发生还原反应
B.充电时,电路中每有1mol电子转移,则有1molLi+由左向右通过聚合物电解质膜
C.该锂离子电池工作时,化学能转化为电能
D.放电时,正极的电极反应式为:LiCoO2-xe-=Li1-xCoO2+xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某物质X能发生如图转化(四种物质均含元素R),回答下列问题:

I.已知常温下Z为一种淡黄色固体,A的水溶液能与铝反应产生氢气,则:
(1)单质X的化学式为_________,工业上Z可以用于____________。(任写一种用途)
(2)A的水溶液与铝反应的离子方程式为_______________________________。
II.若X为一种常见金属单质,白色物质A在空气中易转化为红褐色。则:
(1)Z加入酸性KMnO4溶液中,溶液由紫色褪至无色,说明Z具有________性(填“氧化”、“还原”或“漂白”)。
(2)实验室制备A常会变质,检验其可能变质的方法是将其溶于足量的稀硫酸,然后加入试剂___________,为了较长时间观察A的颜色,可采取的措施有____________。(任写一种)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com