
在一定条件下,合成氨反应达到平衡后,混合气体中NH3的体积分数为25%。若反应前后压强不变,则反应后缩小的气体体积与原反应物体积的比值为( )
A.1∶5 B.1∶4 C.1∶3 D.1∶2
科目:高中化学 来源: 题型:
将6.85g Fe和Al的混合物溶于200mL 浓度为C mol/L的HNO3溶液中,得到标准状况下的NO、N2O混合气体共3.36L,测得反应后溶液的pH为0,再向所得溶液中加入过量NaOH溶液充分反应后生成沉淀质量为5.35 g。若不考虑反应前后溶液体积变化,则下列有关判断正确的是( )。
A.Fe与Al 的物质的量之比为1:1
B.混合气体中NO为0.03mol ,N2O为0.12mol
C.原HNO3溶液的浓度C=4 .9mol/L
.9mol/L
D.反应中被还原的HNO3为0.15mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电离方程式书写错误的是( )
A.NH3·H2O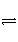
 NH
NH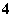 +OH-
+OH-
B.Ba(OH)2===Ba2++2OH-
C.H2SO4===2H++SO
D.NaHCO3===Na++H++CO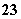
查看答案和解析>>
科目:高中化学 来源: 题型:
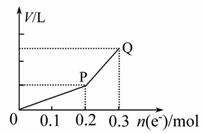 用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体的总体积的关系如下图所示(气体体积均在相同状况下测定),欲使电解质溶液恢复到起始状态,应向溶液中加入( )
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体的总体积的关系如下图所示(气体体积均在相同状况下测定),欲使电解质溶液恢复到起始状态,应向溶液中加入( )
A.0.1 mol CuO
B.0.1 mol CuCO3
C.0.1 mol Cu(OH)2
D.0.05 mol Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
2007年10月10日,德国科学家格哈德·埃尔特生日的当天获得了诺贝尔化学奖,以奖励他在表面化学领域做出的开拓性贡献。合成氨反应在铁催化剂表面进行时效率显著提高,就是埃尔特的研究成果。下列关于合成氨反应的叙述中,正确的是( )
A.铁作催化剂可加快反应速率,且有利于平衡向合成氨的方向移动
B.将氨从混合气中分离,可加快反应速率,且有利于平衡向合成氨的方向移动
C.升高温度可以加快反应速率,且有利于平衡向合成氨的方向移动
D.增大压强可加快反应速率,且有利于平衡向合成氨的方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下表的实验数据是在不同温度和压强下,平衡混合物中NH3含量的变化情况。达到平衡时平衡混合物中NH3的含量(体积分数)[入料V(N2)∶V(H2)=1∶3]
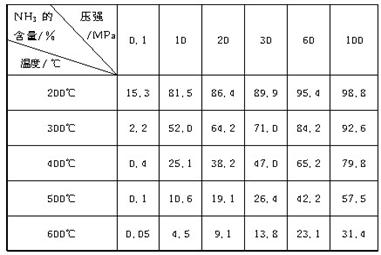
(1)比较200℃和300℃时的数据,可判断升高温度,平衡向____________方向移动,正反应方向为________(填“吸热”或“放热”)反应。
(2)根据平衡移动原理,合成氨适宜的条件是________。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(3)计算500℃,30 MPa时N2的转化率________。
(4)实际工业生产合成氨时,考虑浓度对化学平衡的影响,还采取了一些措施。请写出其中的一个措施:________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于难溶盐MX,其饱和溶液中M+和X-的物质的量浓度之间的关系类似于[H+]·[OH-]=KW,存在等式[M+]·[X-]=Ksp。一定温度下,将足量的AgCl分别加入下列物质中,AgCl的溶解度由大到小的排列顺序是( )
①20 mL 0.01 mol·L-1 KCl;
②30 mL 0.02 mol·L-1 CaCl2溶液;
③40 mL 0.03 mol·L-1 HCl溶液;
④10 mL蒸馏水;
⑤50 mL 0.05 mol·L-1 AgNO3溶液
A.①>②>③>④>⑤ B.④>①>③>②>⑤
C.⑤>④>②>①>③ D.④>③>⑤>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
能用电解原理说明的问题是( )
①电解是把电能转变成化学能 ②电解是化学能转变成电能 ③电解质溶液导电是化学变化,金属导电是物理变化 ④不能自发进行的氧化还原反应,通过电解的原理可以实现 ⑤任何溶液被电解时,必须导致氧化还原反应的发生
A.①②③④ B.②③⑤ C.③④ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制1 mol·L-1的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是________填字母序号)。
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏
B.如果实验中需用60 mL的稀硫酸标准溶液,配制时应选用100 mL容量瓶
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大
E.配制溶液时,定容时俯视读数,则导致实验结果偏大
F.中和滴定结束时俯视读数,则导致实验结果偏大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com