
(15分)常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源
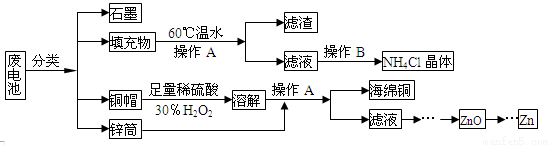
(1)填充物用60℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。
铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,
试写出该反应的化学方程式: 。
(15分)
(1)加快溶解速率(2分)
(2)过滤(2分)
(3)Cu+H2O2+H2SO4=CuSO4+2H2O(2分) 加热(2分)
(4)Zn+2OH--2e-=Zn(OH)2 (2分)
(5)①4(2分)
②2MnO(OH)+6HCl(浓) 2MnCl2+Cl2↑+4H2O (3分)
2MnCl2+Cl2↑+4H2O (3分)
【解析】
试题分析:(1)升高温度,溶解速度加快,所以填充物用60℃温水溶解,目的是:加快溶解速率。
(2)经过操作A得到滤渣和滤液,所以操作A为过滤。
(3)H2O2具有强氧化性,在H2SO4条件下可把Cu氧化为CuSO4,所以化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O;H2O2受热分解生成H2O和O2,所以可用加热的方法除去溶液中过量的H2O2。
(4)根据电池总反应,Zn在负极上失电子生成Zn(OH)2,电极方程式为:Zn+2OH--2e-=Zn(OH)2。
(5)①根据化学方程式,当1 mol MnO2参加反应时,同时有2molMnO(OH)反应,Mn元素均转为Mn2+,共有4mol电子发生转移。
②MnO(OH)与浓盐酸的反应可仿照MnO2与浓盐酸的反应,MnO(OH)把HCl氧化为Cl2,配平可得化学方程式:2MnO(OH)+6HCl(浓) 2MnCl2+Cl2↑+4H2O。
2MnCl2+Cl2↑+4H2O。
考点:本题考查化学流程的分析、基本操作、原电池原理、氧化还原反应原理、化学方程式的书写。


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源:2014-2015安徽省淮南市高二上学期期末考试化学(理)试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A.NaHS水解:HS-+ H2O = S2-+ H3O+
B.向氯化铁溶液中加入铁:Fe3+ + Fe = 2Fe2+
C.氯化铝溶液加入过量的氨水:Al3+ + 4NH3H2O = AlO2-+ 4NH4+ + 2H2O
D.硫酸铜水解:Cu2+ + 2H2O Cu(OH)2 + 2H+
Cu(OH)2 + 2H+
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次月考化学试卷(解析版) 题型:选择题
某原电池的电池反应为:Fe+2Fe3+===3Fe2+,与此电池反应不符的原电池是
A.铜片、铁片、FeCl3溶液组成的原电池
B.石墨、铁片、Fe(NO3)3溶液组成的原电池
C.铁片、锌片、Fe2(SO4)3溶液组成的原电池
D.铜片、铁片、Fe(NO3)3溶液组成的原电池
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次月考化学试卷(解析版) 题型:选择题
某学生的实验报告所列出的下列数据中合理的是
A.用10mL量筒量取7.13mL稀盐酸
B.用托盘天平称量25.20g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省弥勒市高三市统测一模理综化学试卷(解析版) 题型:选择题
酚酞,别名非诺夫他林,是制药工业原料,其结构如图所示,有关酚酞说法不正确的是
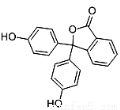
A.分子式为C20H14O4
B.可以发生取代反应、加成反应、氧化反应
C.含有的官能团有羟基、酯基
D.1mol该物质可与H2和溴水发生反应,消耗H2和Br2的最大值为10mol和4mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省丹东五校协作体高三上学期期末考试理综化学试卷(解析版) 题型:填空题
(15分)某同学在探究废干电池内的黑色固体回收利用时,进行如图示实验:

查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、 、 、 ;
(2)操作④的试管加入③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定黑色固体为 。
(3)操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为 。
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,
下面是他做完实验后所写的实验报告,请你写出其空白处的内容:
实验目的 | 操作 | 实验现象 | 结论 |
1、检验Cl— | 取少许滤液于试管中, , | , | 含有Cl— |
2、检验NH4+ | 取少许滤液于试管中, , | , | 含有NH4+ |
3、检验Zn2+ | 取少许滤液于试管中,加入 稀氨水 | 先产生白色沉淀,继续加入氨水,沉淀又溶解 | 含有Zn2+ |
(5)根据以上的实验报告,关于滤液的成分,你的结论是: 。通过一定的操作从滤液中得到固体溶质, 若要将所得固体溶质中的物质加以分离,可用 法。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇市高三第二次质检理综化学试卷(解析版) 题型:选择题
某种聚合物锂离子电池放电时的反应为Li1-xCoO2+LixC6===6C+LiCoO2,其电池如图所示。下列说法不正确的是

A.放电时,LixC6发生氧化反应
B.充电时,Li+通过阳离子交换膜从左向右移动
C.充电时将电池的负极与外接电源的负极相连阳离子交换膜
D.放电时,电池的正极反应为Li1-xCoO2+xLi++xe-===LiCoO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:选择题
设N0表示阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,16 g CH4中含有的原子总数为5N0
B.标准状况下,11.2 LCH3OH中含有的共价键数目为2.5N0
C.常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1N0
D.标准状况下,0.1 mol Cl2被氢氧化钠溶液完全吸收,转移的电子数目为0.2N0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com