
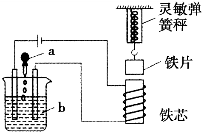
 如图所示,向烧杯内的溶液b中逐渐加入溶液a时,灵敏弹簧秤的读数先逐渐变小然,然后又逐渐变大,则溶液a、b分别是( )
如图所示,向烧杯内的溶液b中逐渐加入溶液a时,灵敏弹簧秤的读数先逐渐变小然,然后又逐渐变大,则溶液a、b分别是( )| A、NaOH、H2SO4 |
| B、BaCl2、NaOH |
| C、Ba(OH)2、Na2SO4 |
| D、NH3?H2O、CH3COOH |


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:

| A、图中对应点的温度关系为:a>b>C |
| B、纯水仅升高温度,可从a点变到c点 |
| C、水的离子积常数KW数值大小关系为:b>c>d |
| D、在b点对应温度下,0.5mol/L的H2SO4溶液与1mol/L的KOH溶液等体积混合,充分反 应后,所得溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10mL水 |
| B、10mL 0.1mol/LCaCl2溶液 |
| C、20mL 0.1mol/LNaHSO4 |
| D、40mL 0.1mol/LNa2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锌为负极,锌发生还原反应Zn-2e-=Zn2+ |
| B、电流方向经外电路由锌到铜 |
| C、工作时SO42-离子向正极移动 |
| D、外电路电子流入的一极为正极,电子流出的一极为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 根据电化学知识回答下列问题.
根据电化学知识回答下列问题.| 通电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 煤的液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先进洁净煤技术.
煤的液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先进洁净煤技术.| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com