
| A. | 碘升华时需要克服分子间作用力,不破坏共价键 | |
| B. | NaCl和HCl溶于水都电离出Cl-,故它们都存在离子键 | |
| C. | 干冰和水分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 离子化合物在任何状态下都能导电 |
分析 A.碘升华发生物理变化,只是物质状态发生变化,破坏分子间作用力;
B.含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物;
C.氢化物中H原子最外层没有达到8电子结构;
D.离子化合物只有含有自由移动离子时才能导电.
解答 解:A.碘升华发生物理变化,只是物质状态发生变化,所以破坏分子间作用力而不破坏化学键,故A正确;
B.含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物,NaCl中只含离子键,为离子化合物,HCl中只含共价键,为共价化合物,故B错误;
C.氢化物中H原子最外层没有达到8电子结构,所以水分子中H原子没有达到8电子结构,故C错误;
D.离子化合物只有含有自由移动离子时才能导电,离子化合物在固态时不含自由移动离子,所以固态时不导电,故D错误;
故选A.
点评 本题考查化学键、原子结构等知识点,为高频考点,明确物质构成微粒及化合物与导电的关系是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 等于25% | B. | 大于25% | C. | 小于25% | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(g)<S(1)<S(s) | B. | S(g)>S(1)>S(s) | C. | S(g)>S(1)=S(s) | D. | S(g)>S(s)>S(1) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
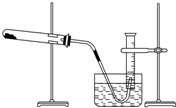 某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量,实验步骤如下:
某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量,实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是复分解反应 | B. | NO发生还原反应 | ||
| C. | CO是氧化剂 | D. | 反应物中O得电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应前酸、碱溶液的温度要相同 | |
| B. | 环形玻璃棒搅拌能加快反应速率,减小实验误差 | |
| C. | 为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸) | |
| D. | 为了使反应更完全,可以使酸或碱适当过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
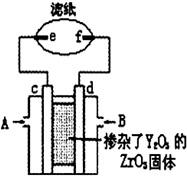 向新型燃料电池的两极分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传到O2-,图中滤纸用含有酚酞的氯化钠溶液浸泡过,c、d、e、f均为惰性电极,工作后e极周围变红,下列叙述正确的是( )
向新型燃料电池的两极分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传到O2-,图中滤纸用含有酚酞的氯化钠溶液浸泡过,c、d、e、f均为惰性电极,工作后e极周围变红,下列叙述正确的是( )| A. | c极为正极,A处通入甲烷气体 | B. | d极的反应式为O2+2H2O+4e-=4OH- | ||
| C. | 固体电解质中O2-由d极向c极移动 | D. | e极上发生氧化反应,pH上升 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com