
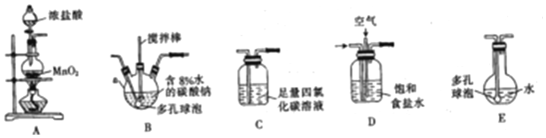
分析 A装置用二氧化锰和浓盐酸制备氯气,由D装置饱和食盐水吸收氯气中的氯化氢气体,与空气形成1:3的混合气体通入B装置,防止反应放热后温度过高导致Cl2O分解,装置B需放在冷水中,在搅拌棒的作用下与含水8%的碳酸钠充分反应制备Cl2O,反应为:2Cl2+Na2CO3═Cl2O+2NaCl+CO2,通入C装置吸收除去Cl2O中的Cl2,并在E装置中用水吸收Cl2O制备次氯酸溶液,据此分析作答.
解答 解:(1)仪器a为三颈烧瓶;
故答案为:三颈烧瓶;
(2)A装置制备氯气,D装置吸收吸收氯气中的氯化氢气体,与空气形成1:3的混合气体通入B装置,与含水8%的碳酸钠充分反应制备Cl2O,C装置吸收除去Cl2O中的Cl2,E装置中用水吸收Cl2O制备次氯酸溶液;
故答案为:A、D、B、C、E;
(3)装置B中多孔球泡和搅拌棒的作用是加快反应速率,使反应充分进行;
故答案为:加快反应速率,使反应充分进行;
(4)氯气和空气(不参与反应)按体积比1:3混合通入含水8%的碳酸钠中制备Cl2O,反应为:2Cl2+Na2CO3═Cl2O+2NaCl+CO2(或2Cl2+Na2CO3+H2O═Cl2O+2NaCl+2NaCO3);
故答案为:2Cl2+Na2CO3═Cl2O+2NaCl+CO2(或2Cl2+Na2CO3+H2O═Cl2O+2NaCl+2NaCO3);
(5)由题可知:Cl2O 42℃以上会分解生成Cl2和O2,故为防止反应放热后温度过高导致Cl2O分解,装置B需放在冷水中;
故答案为:防止反应放热后温度过高导致Cl2O分解;
(6)HClO见光易分解,因避光,故用棕色平底烧瓶;Cl2O为极性分子,Cl2为非极性分子,根据相似相容原理,氯气易溶于四氯化碳,可在装置C中除去Cl2O中的Cl2;
故答案为:棕色;除去Cl2O中的Cl2;
(7)次氯酸可被KI、FeSO4等物质还原出Cl-,根据所选试剂,可用足量FeSO4与次氯酸反应,用高锰酸钾一定剩余的FeSO4,由高锰酸钾的消耗计算次氯酸的浓度,则方法为:用酸式滴定管量取一定体积的次氯酸溶液于锥形瓶中,加入一定体积的0.10mol•L-1 FeSO4溶液(足量),然后用0.10 mol•L-1的KMnO4酸性溶液滴定至溶液变为浅红色,读数;
故答案为:加入一定体积的0.10mol•L-1 FeSO4溶液(足量),然后用0.10 mol•L-1的KMnO4酸性溶液滴定至溶液变为浅红色,读数.
点评 本题考查性质实验方案设计,侧重考查学生知识综合应用、根据实验目的及物质的性质进行排列顺、实验基本操作能力及实验方案设计能力,综合性较强,注意把握物质性质以及对题目信息的获取于使用,难度中等.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
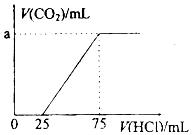 取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积与所加盐酸体积之间的关系如图所示,下列说法正确的是( )
取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积与所加盐酸体积之间的关系如图所示,下列说法正确的是( )| A. | 原溶液中NaOH的物质的量为0.75mol | |
| B. | 通入CO2后所得的溶液溶质成分为NaOH和Na2CO3 | |
| C. | 通入CO2后所得的溶液中含有2.5mol NaHCO3 | |
| D. | 原溶液通入CO2标准状况下为112mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
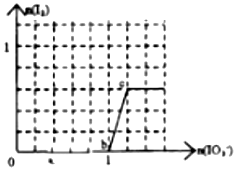 己知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
己知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )| A. | 0~a间发生反应:3HSO3-+IO3-═3SO42-+I-+3H+ | |
| B. | a~b间共消耗NaHSO3的物质的量为1.8mol | |
| C. | b~c间反应:I2仅是氧化产物 | |
| D. | 当溶液中I-与I2的物质的量之比为5:3时,加入的KIO3为1.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝可作胃酸的中和剂 | |
| B. | 绚丽缤纷的烟花中添加了含钾、钙、钠、铜等金属元素的化合物 | |
| C. | SiO2、NaOH、HF三者两两均能反应 | |
| D. | 制备单晶硅的过程中不发生氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com