
利用醋酸二氨合铜[Cu(NH3)2Ac]溶液吸收CO,能 达到保护环境和能源再利用的目的,反应方程式为Cu(NH3)2Ac+CO+NH3
达到保护环境和能源再利用的目的,反应方程式为Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3]Ac·CO。已知该反应的化学平衡常数与温度的关系如表所示:
[Cu(NH3)3]Ac·CO。已知该反应的化学平衡常数与温度的关系如表所示:
| 温度/℃ | 15 | 50 | 100 |
| 化学平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是 ( )。
A.上述正反应为吸热反应
B.15 ℃时,反应[Cu(NH3)]Ac·CO Cu(NH3)2Ac+CO+NH3的平衡常数为0.5
Cu(NH3)2Ac+CO+NH3的平衡常数为0.5
C.保持其他条件不变,减小压强,CO的转化率减小
D.醋酸二氨合铜溶液的浓度大小对CO的吸收没有影响
科目:高中化学 来源: 题型:
4种短周期元素相对位置如右表。M元素既是构成生物体的基本元素,又是构成地壳中岩石和化石燃料的主要元素。回答下列问题:
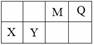
(1)X的原子结构示意图为 。
(2)0.1 molQ的10电子氢化物与CuO反应生成Cu2O、H2O和Q单质时,生成Cu2O的物质的量是 。
(3)Y的氧化物与NaOH溶液反应的化学方程式是 。
(4)HR是含M元素的一元酸。常温下,0.1 mol·L-1 HR 溶液中,c(H+) = 1.3×10-3 mol·L-1。则HR  H++R-的电离平衡常数Ka= (保留一位小数)。
H++R-的电离平衡常数Ka= (保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式硫酸铁Fe(OH)SO4对水中的悬浮物、有机物、硫化物、重金属等都能絮凝,工业上常用硫酸亚铁法制备,工艺流程如下图所示:
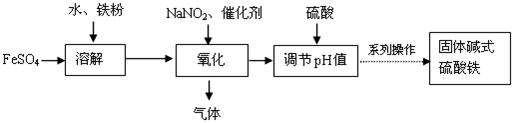
已知: Fe3+沉淀完全时的pH=3.1, Fe2+沉淀完全时的pH=9.7。
(1)请写出溶解过程中加快溶解速率和提高浸出率的两点措施:
_______________________________,______________________________。
(2)加入硫酸的作用是控制体系的pH值,若硫酸加入量过小,反应体系酸度太低,容易生成 沉淀;若硫酸加入量过大,不利于产品形成,试从平衡移动的角度分析原因是 。
(3)氧化过程中生成的气体遇空气变红棕色。写出氧化过程发生的离子方程式:
________________________________________________________________。
(4)流程图中的“系列操作”包括 , ,过滤,洗涤,烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:
A(g)  B(g)+C(g) ΔH=+85.1 kJ·mol-1
B(g)+C(g) ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为____________。
(2)由总 压强p和起始压强p0计算反应物A的转化率α(A)的表达式为______________。平衡时A的转化率为__________,列式并计算反应的平衡常数K__________。
压强p和起始压强p0计算反应物A的转化率α(A)的表达式为______________。平衡时A的转化率为__________,列式并计算反应的平衡常数K__________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反 应物A的物质的量n(A),n(总)=________ mol,n(A)=________ mol。
应物A的物质的量n(A),n(总)=________ mol,n(A)=________ mol。
②下表为反应物A浓度与反应时间的数据,计算:a=________。
| 反应时间t/h |
| 4 | 8 | 16 |
| c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔( Δt)的规律,得出的结论是________________________________,由此规律推出反应在12 h时反应物的浓度c(A)为__________
Δt)的规律,得出的结论是________________________________,由此规律推出反应在12 h时反应物的浓度c(A)为__________
mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
随着汽车数量的逐年增多,汽车尾气污染已成为突出的环境问题之一。反应:2NO(g)+2CO(g)  2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
A.提高尾气净化效率的最佳途径是研制高效催化剂
B.提高尾气净化效率的常用方法是升高温度
C.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
D.570 K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳
查看答案和解析>>
科目:高中化学 来源: 题型:
向一容积不变的密闭容器中充入一定量A和B,发生反应:xA(g)+2B(s)  yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
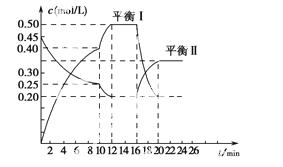
(1)用A的浓度变化表示该反应0~10 min内的平均反应速率v(A)=________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是________;第16 min引起曲线变化的反应条件可能是________。
①减压 ②增大A的浓度 ③增大C的量 ④升温
⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ的平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列配制的溶液浓度偏高的是( )
配制硫酸用量筒量取硫酸时俯视刻度线
配制盐酸定容时,仰视容量瓶刻度线
NaOH溶解后未经冷却即注入容量瓶至刻度线
称量4gNaOH配制0.1mol/L NaOH溶液1000ml时,砝码错放左盘
查看答案和解析>>
科目:高中化学 来源: 题型:
将250mLH2SO4的质量分数为98%,密度为1.84g/cm3的浓硫酸稀释到1000mL。
(1)稀释前溶液中H2SO4的物质的量浓度是多少?
(2)稀释后溶液中H+的物质的量浓度是多少?
(3 )若要制取3.36LH2 (标准状况),则要用量筒量取稀释后的硫酸溶液多少毫升?
查看答案和解析>>
科目:高中化学 来源: 题型:
两人用同一瓶盐酸滴定同一瓶NaOH溶液。甲将锥形瓶用NaOH待测液润洗后,使用水洗过的碱式滴定管取碱液于锥形瓶中 ;乙则用甲用过的滴定管取碱液于刚用蒸馏水洗过且存有
;乙则用甲用过的滴定管取碱液于刚用蒸馏水洗过且存有 蒸馏水的锥形瓶中,其他操作及读数均正确,你的判断是(
蒸馏水的锥形瓶中,其他操作及读数均正确,你的判断是(  )
)
A.甲操作有错
B.乙操作有错
C.甲测定数值一定比乙小
D.乙实际测得值较准确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com