
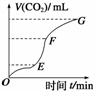
现欲用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如图所示,分析判断OE、EF、FG三段中,__________段化学反应速率最快,__________段收集的二氧化碳最多。
(2)为了降低上述化学反应的反应速率,欲向溶液中加入下列物质,你认为可行的是( )
A.蒸馏水 B.NaCl固体 C.NaCl溶液 D.浓盐酸
(3)除了上述方法外,你认为还可以采取哪些措施来降低化学反应速率?
科目:高中化学 来源: 题型:
短周期主族元素M、X、Y、R、W的原子序数逐渐增大,X原子的p轨道半充满,且X、Y同周期,Y与R的价电子数相同.R原子核外有16个运动状态不同的电子。
(1)X元素的基态原子的电子排布图为__________________,R元素的基态原子有____个未成对电子。
(2)Y与Na的离子半径由小到大的顺序为 ;(用元素符号表示)
(3)上述元素的最高价氧化物对应的水化物酸性最强的是 (写化学式).该元素在周期表中的位置为________________________________
(4)短周期元素M与Al元素位于不同主族,但由于二者的电负性相近,导致某些性相似,将M的最高价氧化物溶于氢氧化钠溶液中,发生反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硅(SiO2)又称硅石,是制备硅及其化合物的重要原料,物质间的转化关系如图所示。下列说法正确的是(双选)( )。
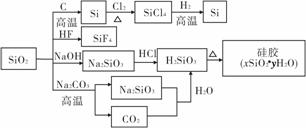
A.SiO2既能与HF反应, 又能与NaOH反应,属于两性氧化物
B.SiO2是光导纤维材料,Si是半导体材料
C.在硅胶中加入CoCl2可显示硅胶是否吸水失效
D.图中所示转化反应都是非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于催化剂的说法,正确的是( )
A.催化剂能使不起反应的物质发生反应
B.催化剂在化学反应前后,化学性质和质量都不变
C.催化剂不能改变化学反应速率
D.任何化学反应,都需要催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,可逆反应N2(g)+3H2(g)
 2NH3(g) ΔH<0,达到平衡,当单独改变下列条件后,有关叙述错误的是( )
2NH3(g) ΔH<0,达到平衡,当单独改变下列条件后,有关叙述错误的是( )
A.加催化剂,v正、v逆都发生变化且变化的倍数相等
B.加压,v正、v逆都增大,且v正增大倍数大于v逆增大倍数
C.降温,v正、v逆都减小,且v正减小倍数小于v逆减小倍数
D.加入氩气,v正、v逆都增大,且v正增大倍数大于v逆增大倍数
查看答案和解析>>
科目:高中化学 来源: 题型:
在C(s)+CO2(g)===2CO(g)的反应中,现采取下列措施:
①缩小体积,增大压强 ②增加碳的量③通入CO2④恒容下充入N2⑤恒压下充入N2
能够使反应速率增大的措施是( )
A.①④ B.②③⑤ C.①③ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
有甲、乙两容器,甲容器容积固定,乙容器容积可变。一定温度下,在甲中加入2 mol N2、3 mol H2,反应N2(g)+3H2(g)
 2NH3(g)达到平衡时生成NH3的物质的量为m mol。
2NH3(g)达到平衡时生成NH3的物质的量为m mol。
(1)相同温度下,在乙中加入4 mol N2、6 mol H2,若乙的压强始终与甲的压强相等,乙中反应达到平衡时,生成NH3的物质的量为________mol(从下列各项中选择,只填序号,下同);若乙的容积与甲的容积始终相等,乙中反应达到平衡时,生成NH3的物质的量为________mol。
A.小于m B.等于m C.在m~2m之间 D.等于2m E.大于2m
(2)相同温度下,保持乙的容积为甲的一半,并加入1 mol NH3,要使乙中反应达到平衡时各物质的体积分数与上述甲容器中达到平衡时相同,则起始应加入______mol N2和________mol H2。
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列装置中,MSO4和NSO4是两种常见金属的易溶盐。当K闭合时,SO 从右到左通过交换膜移向M极,下列分析正确的是(双选)( )
从右到左通过交换膜移向M极,下列分析正确的是(双选)( )
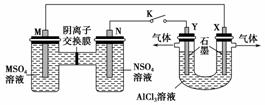
A.溶液中c(M2+)减小
B.N的电极反应式:N-2e-===N2+
C.X电极上有H2产生,发生还原反应
D.反应过程中X电极周围生成白色胶状沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Ba2+有很强的毒性,医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸酸性很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是______________________(用沉淀溶解平衡原理解释)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com