
【题目】“绿色化学实验”已走进课堂,下列说法符合“绿色化学”的是()
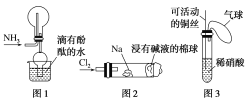
①实验室收集氨气采用图1所示装置
②实验室中做氯气与钠反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A.②③④B.①②③C.①③④D.①②④
【答案】D
【解析】
①实验室收集氨气采用图1所示装置,在制备的过程中用向下排空气法收集、带有酚酞的水吸收溢出的氨气防止污染环境,故符合绿色化学的要求;
②实验室中做氯气与钠的反应实验时采用图2所示装置,用沾有碱液的棉团可以吸收多余的氯气,防止污染环境,因此也符合绿色化学的范畴;
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验,挥发的氯化氢和氨气会污染大气,因此不符合绿色化学的要求;
④实验室中采用图3所示装置进行铜与稀硝酸的反应,可活动的铜丝可控制反应物用量、生成的氮的氧化物及时收集在气球里面,也可以做到防止污染环境,也符合绿色化学的要求;
综上所述①②④符合要求,故答案选D。


科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式如如图。
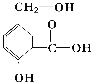
(1)请写出该物质的含氧官能团名称______、______和______。
(2)请写出以下化学反应的方程式:
①A跟NaOH溶液反应:__________
②A跟NaHCO3溶液反应:__________
③A在一定条件下跟Na反应:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上有一种方法是用CO2生产燃料甲醇(CH3OH)。反应的化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
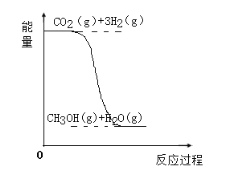
(1)该反应是__反应(填“吸热”或“放热”),判断的理由是___。
(2)某温度时,在体积为2L的密闭容器中,充入1molCO2和3molH2,测得CO2的物质的量随时间变化如下表所示:
时间/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.85 | 0.7 | 0.25 | 0.25 |
从反应开始到5min末,用CO2表示的该反应的平均速率为__;反应达平衡时,H2的转化率为__;要提高此反应的速率,可以采取___措施(填写2条)。
(3)若维持(2)的条件不变,能说明该反应已达平衡状态的是__(填序号)。
A.v生成(CH3OH)=v消耗(CO2)
B.CO2、H2、CH3OH、H2O浓度相等的状态
C.CO2、H2、CH3OH、H2O总物质的量保持不变的状态
D.CO2的转化率保持不变的状态
(4)依据原电池原理,将甲醇设计成燃料电池如图:
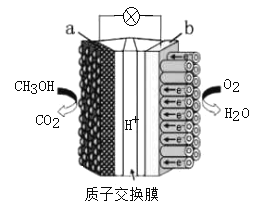
则a为__极(填“正”或“负”);H+从__极区向__极区迁移(用图中字母填);b极上O2发生反应电极反应式为:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是()
A.1 mol硫单质在过量氧气中完全燃烧产生NA个SO3分子
B.5.4 g铝单质与足量NaOH溶液反应,转移电子数为0.6NA
C.标准状况下,36 g H2O中含有氧原子数为1 mol
D.标准状况下,22.4 L SO3中含有氧原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红帘石矿的主要成分为Fe3O4、Al2O3、MnCO3、Mg0少量MnO2等。工业上将红帘石处理后运用阴离子膜电解法的新技术提取金属钰并制得绿色高效的水处理剂(K2FeO4)。工业流程如下:
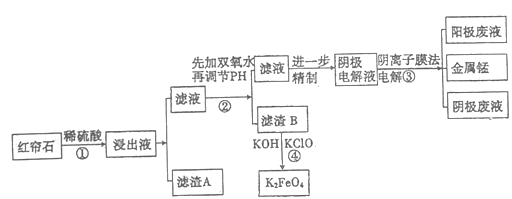
(1)在稀硫酸浸取矿石的过程中,MnO2可将Fe2+氧化为Fe3+,写出该反应的离子方程式:________。
(2)浸出液中的阳离子除H+、Fe2+、Fe3+外还有_______(填离子符号)。
(3)已知:不同金属离子生成生成氢氧化物沉淀所需的pH如下表:
离子 | Fe3+ | A13+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.6 |
完全沉淀的pH | 3.7 | 4.7 | 9.6 | 9.8 | 11.1 |
步骤②中调节溶液的pH等于6,调节pH的试剂最好选用下列哪种试剂:_______(填选项字母,下同)滤渣B除掉杂质后可进一步制取K2FeO4,除掉滤渣B中杂质最好选用下列哪种试剂:_____。
a.稀盐酸 b.KOH c.氨水 d.MnCO3 e.CaCO3
(4)滤渣B经反应④生成高效水处理剂的离子方程式_______________。
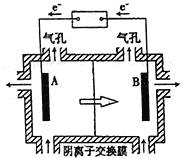
(5)电解装置如图所示,箭头表示溶液中阴离子移动的方向;则与A电极连接的是直流电源的_____极。阳极电解液是稀硫酸,若阴极上只有锰单质析出,当生成11g锰时,另一个电极上产生的气体在标准状况下的体积为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为________。
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为__________,C的元素符号为____________;B的外围电子的轨道表示式为___________。
(3)D元素的正三价离子的3d轨道为半充满,D的元素符号为________________,其基态原子的电子排布式为________________________。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为________,其基态原子的电子排布式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】花椒毒素(H)有抗实验性心律失常、镇痛、抗炎等作用。由芳香族化合物A为原料合成H的一种合成路线如下:
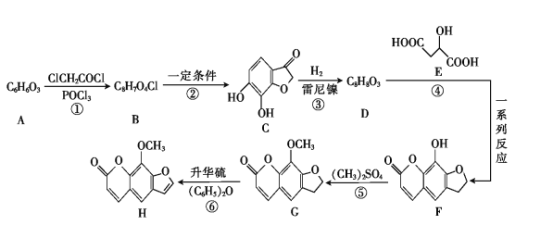
已知:![]() +ClCH2CH2Cl
+ClCH2CH2Cl![]()
![]() +HCl
+HCl
回答下列问题:
(1)A的化学名称是 _____(用系统命名法)。
(2)G中所含官能团的名称是 ____。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。E中___ (填“有”或“没有”)手性碳。
(4)反应⑥的反应类型是 ____ 。
(5)D的结构简式为 _____。
(6)F与足量NaOH溶液反应的化学方程式为 ____。
(7)芳香族化合物W是D的同分异构体,能发生银镜反应和水解反应,遇FeCl3溶液发生显色反应;W的核磁共振氢谱有5组峰,且面积比为1∶2∶2∶2∶1。符合上述要求的W有____种。
(8)有机物M(![]() )是一种重要的化工原料。设计由邻苯二酚和氯乙酰氯(ClCH2COCl)为起始原料制备有机物M的合成路线____。(无机试剂及有机溶剂任用)
)是一种重要的化工原料。设计由邻苯二酚和氯乙酰氯(ClCH2COCl)为起始原料制备有机物M的合成路线____。(无机试剂及有机溶剂任用)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二氧化碳为原料制备尿素工艺被广泛研究。其反应机理为:
反应Ⅰ:CO2(g)+2NH3(g)NH2COONH4(l) H1=-117.2 kJ·mol1
反应Ⅱ:NH2COONH4(l)NH2CONH2(l)+H2O(l) H2= +15.0 kJ·mol1
(1)反应Ⅰ平衡常数K的表达式为_____________。
(2)由CO2(g)和NH3(g)合成尿素NH2CONH2(l)的热化学方程式是__________。
(3)在恒容容器中按物质的量之比1∶2通入CO2和NH3,下列不能说明合成尿素反应达平衡状态的是_________。
A.容器中气体平均相对分子质量不再变化
B.容器中气体密度不再变化
C.NH3的体积分数不再变化
D.容器内压强不再变化
(4)通过实验发现,其他条件不变时,改变NH3、CO2的物质的量之比可增加尿素的产率,如图为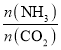 与尿素产率的关系曲线。通过曲线可知:______________过量对尿素产率的影响比较小。若在固定容器中按
与尿素产率的关系曲线。通过曲线可知:______________过量对尿素产率的影响比较小。若在固定容器中按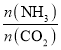 等于3.0通入CO2和NH3,则合成尿素反应达平衡后,混合气体中CO2的物质的量分数为________(精确到0.1%)。
等于3.0通入CO2和NH3,则合成尿素反应达平衡后,混合气体中CO2的物质的量分数为________(精确到0.1%)。
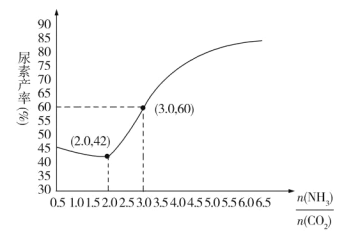
(5)探究发现,温度、压强、n(H2O)条件对合成尿素反应的影响如图1、图2,根据图像回答下列问题:
①其他条件不变时,对于合成尿素的反应,若通入CO2物质的量一定,按三种投料比[分别为 3.0、3.5、4.0]投料时,得到如图1的横轴对CO2的平衡转化率的影响曲线。曲线A对应的投料比是________。
②图2中a、b、c、d 四条曲线中的两条代表压强分别为20 MPa、25 MPa时CO2平衡转化率曲线,其中表示20MPa的是_________(填字母)。在实际生产中采用图2中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga______As,第一电离能Ga________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为_____________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是____________。
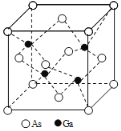
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol-1 和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。
Ⅱ.醋酸铜可合成复合材料石墨烯Cu,其制备原料为CuSO4、NH3·H2O和醋酸等。
(1)写出一种与SO42-互为等电子体的分子__________。
(2)二聚醋酸铜的结构示意图如图所示,Cu2+的配位数为___________。
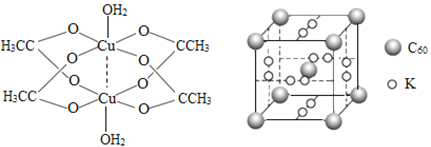
(3)石墨烯可转化为富勒烯(C60),C60和K能形成新型化合物,其晶胞如图所示,晶胞参数为a nm该化合物中K原子和C60分子的个数比为______,该晶体的密度ρ=______g/cm3(列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com