
口服抗菌药利君沙的制备原料G和某种广泛应用于电子电器等领域的高分子化合物Ⅰ的合成路线如下:

已知:①R—CH2—CH===CH2 R—CHCl—CH===CH2
R—CHCl—CH===CH2
②R—CH2—CH===CH2  R—CH2CH2CH2CHO
R—CH2CH2CH2CHO
(1)A的结构简式是________,D中的官能团的名称是________。
(2)写出B―→C的化学方程式:___________________________________________,
该反应类型是____________________。
(3)H的分子式为C8H6O4,能与碳酸钠溶液反应放出气体,其一氯取代物只有一种,写出H的结构简式:_____________________________________________________
(4)写出E+H―→I的化学方程式:______________________________。
(5)J是比C多一个碳原子的C的同系物,J可能的稳定结构有________种(①考虑顺反异构;②“ ”结构不稳定),请任意写出其中一种的结构简式:______________。
”结构不稳定),请任意写出其中一种的结构简式:______________。
(6)关于G的说法中正确的是________(填序号)。
a.1 mol G可与2 mol NaHCO3反应
b.G可发生消去反应
c.1 mol G可与2 mol H2发生加成反应
d.G在一定条件下可与Cl2发生取代反应
(1)CH3—CH===CH2 醛基、羟基
(2)Cl—CH2—CH===CH2+NaOH HO—CH2—CH===CH2+NaCl 取代反应
HO—CH2—CH===CH2+NaCl 取代反应


(6)ad
【解析】根据题中信息和转化关系可知A、B、C、D、E、F、G、H、I分别为CH3—CH===CH2、Cl—CH2—CH===CH2、HO—CH2—CH===CH2、HO—CH2—CH2—CH2CHO、HO—CH2CH2CH2CH2—OH、OHCCH2CH2CHO、HOOCCH2CH2COOH、
 。
。
根据信息可知,J可能的稳定结构有CH2===CHCH2CH2OH、


 5种
5种
(6)1 mol HOOCCH2CH2COOH有2 mol —COOH,可以与2 mol NaHCO3反应;G不能发生消去反应;—COOH不能发生加成反应;G在光照条件下可与Cl2发生取代反应。


科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题1物质的组成分类性质及化学用语练习卷(解析版) 题型:选择题
下列用品的有效成分及用途对应错误的是(双选)( )。
ABCD
用品



有效成分NaClNa2CO3Al(OH)3NaClO
用途做调味品做发酵粉做抗酸药做消毒剂
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题11有机化学基础练习卷(解析版) 题型:选择题
红斑素、红曲素是常用于糖果、雪糕等食品着色剂的主要成分,结构如下图所示。

下列说法正确的是(双选)( )。
A.红斑素和红曲素互为同分异构体
B.红斑素和红曲素都能与NaOH溶液反应
C.红斑素中含有醚键、酯基、羰基等三种含氧官能团
D.1 mol红曲素最多能与6 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题10常见非金属元素及其重要化合物练习卷(解析版) 题型:选择题
物质间纷繁复杂的转化关系是化学的魅力所在,下列选项中物质的转化在一定条件下不能实现的是( )。

查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 综合实验设计练习卷(解析版) 题型:实验题
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的最佳物质的量之比为________ ;为了吸收该反应中产生的尾气,可选择的最佳装置是________(填序号)。

(2)为符合绿色化学的要求,某研究性学习小组进行如下 设计。
方案1:以空气为氧化剂。将铜粉在仪器N中反复灼烧,使铜与空气充分反应生成氧化铜,再使氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与烯硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,再通入空气或氧气,即发生反应,生成硫酸铜。反应完全后,加入物质甲调节pH,铁元素全部转化为Fe(OH)3沉淀(一般当铁离子的浓度下降到10-5mol·L-1时,就认为沉淀完全),然后过滤、浓缩、结晶。
(已知:常温下,Ksp[Cu(OH)2]=10-22,Ksp[Fe(OH)3]=10-38)
请回答下列问题:
①方案1中仪器N的名称是________。
②方案2中为了使铁元素全部沉淀,应调节pH至少为________。
③方案2中甲物质可选用________(填序号)。
A.CaO B.NaOH C.CuCO3 D.Cu2(OH)2CO3 E.Fe2(SO4)3
④方案2反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因:___________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 基本概念、基本理论练习卷(解析版) 题型:填空题
氮是地球上含量丰富的一种元素,氨、肼(N2H4)和叠氮酸都是氮元素的重要氢化物,在工农业生产、生活中有着重大作用。
(1)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响。
①在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
2NH3(g) ΔH<0,其平衡常数K与温度T的关系如下表。
T/K | 298 | 398 | 498 |
平衡常数K | 4.1×106 | K1 | K2 |
则该反应的平衡常数的表达式为________;判断K1________K2(填“>”、“<”或“=”)。
②下列各项能说明该反应已达到平衡状态的是________(填字母)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③一定温度下,在1 L密闭容器中充入1 mol N2和3 mol H2并发生上述反应。若容器容积恒定,10 min达到平衡时,气体的总物质的量为原来的 ,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。
,则N2的转化率为________,以NH3的浓度变化表示该过程的反应速率为________。
(2)肼可用于火箭燃料、制药原料等。
①在火箭推进器中装有肼(N2H4)和液态H2O2,已知0.4 mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6 kJ的热量。该反应的热化学方程式为________________________________________________________________________。
②一种肼燃料电池的工作原理如图所示。该电池工作时负极的电极反应式为_____________________________________。

③加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该反应的化学方程式_______________________________________。
肼与亚硝酸(HNO2)反应可生成叠氮酸,8.6 g叠氮酸完全分解可放出6.72 L氮气(标准状况下),则叠氮酸的分子式为________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 图像、图表练习卷(解析版) 题型:填空题
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。

(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)===IO-(aq)+O2(g) ΔH1
②IO-(aq)+H+(aq) HOI(aq) ΔH2
HOI(aq) ΔH2
③HOI(aq)+I-(aq)+H+(aq) I2(aq)+H2O(l) ΔH3
I2(aq)+H2O(l) ΔH3
总反应的化学方程式为_________________________________,其反应热ΔH=________。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq) I3—(aq),其平衡常数表达式为________。
I3—(aq),其平衡常数表达式为________。
(3) 为探究Fe2+对O3氧化I-反应的影响(反应体系如上图),某研究小组测定两组实验中I3—浓度和体系pH,结果见下图和下表。
编号 | 反应物 | 反应前pH | 反应后pH |
第1组 | O3+I- | 5.2 | 11.0 |
第2组 | O3+I-+Fe2+ | 5.2 | 4.1 |
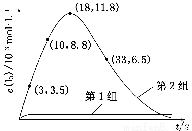
图2
①第1组实验中,导致反应后pH升高的原因是_____________________________
②图1中的A为________。由Fe3+生成A的过程能显著提高I-的转化率,原因是_____________________________________________
③第2组实验进行18 s后,I3—浓度下降。导致下降的直接原因有(双选)________。
A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图2,计算3~18 s内第2组实验中生成I3—的平均反应速率(写出计算过程,结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺选择题限时提速专练 定量分析练习卷(解析版) 题型:选择题
已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100 mL该条件下的CaSO4饱和溶液中加入400 mL 0.01 mol·L-1Na2SO4溶液,针对此过程的下列叙述正确的是 ( )

A.溶液中析出CaSO4沉淀,最终溶液中c(SO42—)较原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42—)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42—)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42—)较原来的大
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 电解质溶液与电离平衡练习卷(解析版) 题型:选择题
下列有关说法中正确的是( )
A.常温下,将1 L pH=12的氨水加水稀释为10 L后溶液的pH=11
B.有甲、乙两醋酸溶液,测得甲的pH=a,乙的pH=a+1,若用于中和等物质的量浓度等体积的NaOH溶液,需甲、乙两酸的体积V (乙)>10V(甲)
C.向浓度均为0.1 mol· 的MgCl2、CuCl2混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]
的MgCl2、CuCl2混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]
D.水的离子积常数KW随着温度的升高而增大,说明水的电离是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com