
| A. | 在0.1mol/L NaHCO3溶液中:c(Na+)+c(H+)═c(HCO3-)+2c(CO32-) | |
| B. | 在0.1mol/L Na2CO3溶液中:2c(Na+)═c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | 物质的量浓度相等的CH3COOK和CH3COOH溶液中,溶液显酸性:c(CH3COO-)>c(CH3COOH) | |
| D. | 物质的量浓度相等的①NH4HSO4溶液、②NH4HCO3溶液、③NH4Cl溶液中的c(NH4+):①>②>③ |
分析 A.根据碳酸氢钠溶液中的电荷守恒分析;
B.根据碳酸钠溶液中的物料守恒判断;
C.混合液呈酸性,说明醋酸根离子的水解程度小于醋酸的电离程度;
D.硫酸氢铵中氢离子抑制了铵根离子的水解,碳酸氢铵中碳酸氢根离子促进了铵根离子的水解.
解答 解:A.在0.1mol/L NaHCO3溶液中,根据电荷守恒可知:c(Na+)+c(H+)═c(HCO3-)+2c(CO32-)+c(OH-),故A错误;
B.在0.1mol/L Na2CO3溶液中,根据物料守恒可得:c(Na+)═2c(HCO3-)+2c(CO32-)+2c(H2CO3),故B错误;
C.物质的量浓度相等的CH3COOK和CH3COOH溶液中,溶液显酸性,说明醋酸根离子的水解程度小于醋酸的电离程度,则c(CH3COO-)>c(CH3COOH),故C正确;
D.物质的量浓度相等的①NH4HSO4溶液、②NH4HCO3溶液、③NH4Cl溶液中,①中氢离子抑制了铵根离子的水解,该溶液中铵根离子浓度最大,②中碳酸氢根离子促进了铵根离子的水解,其溶液中铵根离子浓度最小,则溶液中c(NH4+)的大小为:①>③>②,故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理、电荷守恒、物料守恒的含义为解答关键,注意掌握判断离子浓度大小的常用方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HCO${\;}_{3}^{-}$)>c(H+)>c(OH-) | |
| B. | c(HCO${\;}_{3}^{-}$)>c(ClO-)>c(OH-) | |
| C. | c(HClO)+c(ClO-)=c(HCO${\;}_{3}^{-}$)+c(H2CO3) | |
| D. | c(Na+)+c(H+)=c(HCO${\;}_{3}^{-}$)+c(ClO-)+c(OH-)+c(CO${\;}_{3}^{2-}$) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
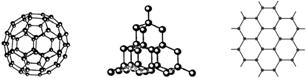
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
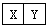 ,它们的单质都必须采用电解法制备,但都无需密封保存,
,它们的单质都必须采用电解法制备,但都无需密封保存, .(2)Y元素在周期表中位置第三周期ⅢA族.
.(2)Y元素在周期表中位置第三周期ⅢA族.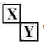 ,X、Y的最高价含氧酸的浓溶液都有强氧化性.
,X、Y的最高价含氧酸的浓溶液都有强氧化性.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | C2H4(g) | H2O(g) | C2H5OH(g) |
| 物质的量分数 | 0.25 | 0.25 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25.4d mol•L-1 | B. | 12.7d mol•L-1 | C. | 6.97d mol•L-1 | D. | 6.35d mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 易溶于水,也易溶于有机溶剂 | |
| B. | 1 mol该烃含有4 mol碳碳双键 | |
| C. | 能发生聚合反应,其产物可表示为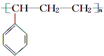 | |
| D. | 既能使溴水褪色,又能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:C>N | B. | 酸性:HClO4>H2CO3 | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 热稳定性H2O>H2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com