
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | B. | 乙酸的分子式为:C2H4O2 | ||
| C. | 乙醛的结构简式:CH3COH | D. | 比例模型 可以表示CO2 分子 可以表示CO2 分子 |
 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:选择题
| A. | 鉴别葡萄糖溶液和淀粉溶液:加入新制的Cu(OH)2悬浊液加热或加碘水 | |
| B. | 鉴别织物成分是真丝还是人造丝:用灼烧的方法 | |
| C. | 鉴别淀粉溶液和蛋白质溶液:加入稀KI溶液 | |
| D. | 鉴别乙烷和乙烯:分别将气体通入溴水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 3.8 | - |
| Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
| Fe(OH)2 | 8.0×10-16 | 6.95 | 9.95 |
| Ni(OH)2 | 6.5×10-18 | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰乳中通入Cl2制漂白精的离子反应方程式为:4OH-+2Ca2++2Cl2═2Cl-+Ca(ClO)2↓+2H2O | |
| B. | NaHCO3中滴入少量Ba(OH)2溶液,其离子方程式正确的是:H++CO32-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 1.0 mol•L-1的KNO3溶液中H+、Fe2+、Cl-、SO42- 能大量共存 | |
| D. | pH=12的溶液中K+、Na+、CH3COO-、Br-能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 标准状况下,11.2LNO2气体含有的分子数为 NA | |
| C. | 将1mol FeCl3水解制成胶体,所得胶体中含有的胶体粒子数NA | |
| D. | 2.0gH218O与D2O的混合物中所含中子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 15 g-CH3(甲基)含有中子数为6 NA | |
| B. | 5.6 g Fe粉完全溶于HCl和H2SO4的混合稀溶液,生成气体分子的数目为0.1 NA | |
| C. | 标准状况下,2.24 L NO2与N2O4的混合气体中含有氮原子的数目为0.1 NA | |
| D. | 在过氧化钠与CO2的反应中,每生成0.1 mol氧气,转移电子的数目为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | 最简单氢化物的沸点:Y>W | |
| C. | 化合物Z2Y2与X2Y2中化学键完全相同 | |
| D. | 由Y、Z、W三种元素组成的化合物的水溶液一定显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
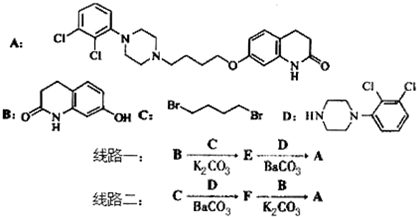
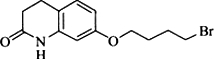 ,其含氧官能团有肽键、醚键(写名称).
,其含氧官能团有肽键、醚键(写名称).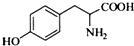 、
、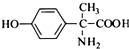 .
.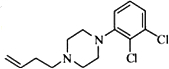 .
.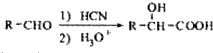 写出由C制备化合物
写出由C制备化合物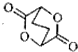
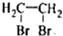
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com