
| A. | v(A)=0.15 mol•L-1•min-1 | B. | v(B)=0.01 mol•L-1•s-1 | ||
| C. | v(C)=0.40 mol•L-1•min-1 | D. | v(D)=0.0075 mol•L-1•s-1 |
分析 比较四种不同情况下反应速率的快慢,利用速率之比等于其化学计量数之比计算同一物质表示的速率进行比较.
解答 解:v(A):v(B):v(C):v(D)=1:3:2:2,转化为用A的浓度变化来表示的反应速率为:
A、v(A)=0.15 mol•L-1•min-1;
B、v(B)=0.01 mol•L-1•s-1×60 s•min-1=0.60 mol•L-1•min-1,则v(A)=$\frac{1}{3}$v(B)=0.20 mol•L-1•min-1;
C、v(C)=0.40 mol•L-1•min-1,则v(A)=$\frac{1}{2}$v(C)=0.20 mol•L-1•min-1;
D、v(D)=0.0075 mol•L-1•s-1,则v(A)=$\frac{1}{2}$(D)=0.00375×60 mol•L-1•min-1=0.225mol•L-1•min-1.故反应进行的最快的为D,
故选:D.
点评 本题考查化学反应速率快慢比较,难度不大,常利用速率与其化学计量数比值大小比较或转化为同一物质表示的速率比较.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 60g乙酸与足量乙醇发生酯化反应.充分反应后断裂的C-O键数目为NA | |
| B. | 室温下向1LpH=1的醋酸溶液中加水,所得溶液的H+数目大于0.1NA | |
| C. | 某无水乙醇与足量金属钠反应生成5.6LH2,该乙醇分子中共价键总数为4NA | |
| D. | 己知C2H4(g)+H2(g)=C2H4(g)△H=-137.0kJ/mol,乙烯与H2加成时放出68.5kJ热量,则反应过程中被破坏的碳原子之间共用电子对数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Na+、OH-、SO42- | B. | H+、Na+、I-、Cl- | ||
| C. | HCO3-、K+、NO3-、OH- | D. | H+、Fe2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 试回答:
试回答: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏自来水可得到蒸馏水 | B. | 酸溶法除去Al2O3的Fe2O3 | ||
| C. | 过滤法除去乙酸中的乙醇 | D. | 碱溶法除去Al2O3中的SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素中有两种元素在第二周期 | |
| B. | W所在主族的元素的原子次外层电子数不可能为18 | |
| C. | X、Y、Z的最高价氧化物对应的水化物之间能两两反应 | |
| D. | 工业上获得X、Y单质的方法主要是电解其熔融的氯化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Na2S去除废水中的Hg2+,Hg2++S2-═HgS↓ | |
| B. | 向Fe(NO3)2溶液中滴人稀硫酸.溶液由浅绿色变为黄色3Fe2++4H++NO3-=3Fe2++NO↑+2H2O | |
| C. | 用醋酸、淀粉碘化钾试纸检测加碘食盐中是否有KIO3,IO3-+6I-+6H+=3I2+3H2O | |
| D. | 消毒液的主要成分为NaClO溶液,与洁厨灵混用.产生有毐Cl2,2H+++Cl-+ClO-=Cl2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
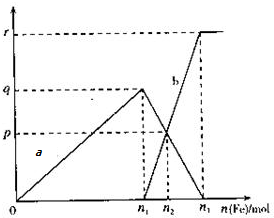 在11.2mol/L的稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入的铁粉的物质的量的关系如图所示(其中纵坐标为氧化产物的物质的量,横坐标为加入铁粉的物质的量),请回答以下问题:
在11.2mol/L的稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入的铁粉的物质的量的关系如图所示(其中纵坐标为氧化产物的物质的量,横坐标为加入铁粉的物质的量),请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:HI>HBr>HCl>HF | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 还原性强弱:Cl-<Br-<I- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com