
【题目】在一定条件下,N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法正确的是
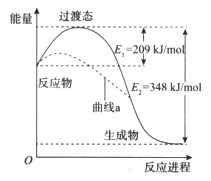
A. 该反应放出了348 kJ的热量
B. 曲线a可能是反应使用了催化剂
C. 断键吸收能量之和大于成键释放能量之和
D. N2O(g)+NO(g)=N2(g)+NO2(g) ![]() =-139kJ/mol
=-139kJ/mol
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】葡萄糖酸亚铁[(C6H11O7)2Fe2H2O]是重要的矿物质添加剂,它的吸收效果比无机铁盐好。一种工业上制备葡萄糖酸亚铁的工艺流程如下:
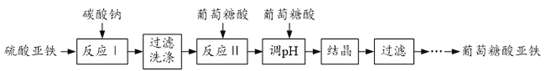
(1)反应Ⅰ的化学方程式为______。
(2)①碳酸亚铁过滤时需在表面保留水层的原因是______;
②检验FeCO3已经洗涤干净的操作为______。
(3)反应Ⅱ后加入葡萄糖酸调节溶液pH至5.8,其原因是______。
(4)葡萄糖酸亚铁溶液结晶、洗涤时均需加入乙醇,其目的分别是______,______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于说法正确的是( )
A. HCl和NaOH反应的中和热△H=﹣57.3 kJ/mol。则H2SO4和Ba(OH)2反应的中和热△H=2×(﹣57.3) kJ/mol
B. 已知C2H5OH(l)的燃烧热是1366.8 kJ/mol,则C2H5OH(l)+3O2(g) ═ 2CO2(g)+3H2O(g) 反应的△H=-1366.8 kJ/mol
C. 一定条件下2SO2(g)+O2(g)![]() 2SO3(g) △H1<0,2SO2(g)+O2(g)
2SO3(g) △H1<0,2SO2(g)+O2(g)![]() 2SO3(l) △H2<0,则△H1>△H2
2SO3(l) △H2<0,则△H1>△H2
D. 在一定温度和压强下,将0.5mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放出热量19.3 kJ,则其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=﹣38.6kJ/mol
2NH3(g) △H=﹣38.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以乙醇为原料经一系列反应可以得到4羟基扁桃酸和香豆素3羧酸,二者的合成路线如下(部分产物及条件未列出):
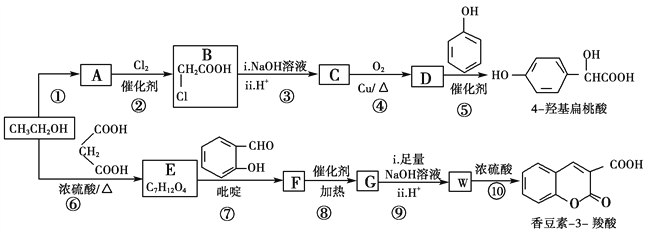
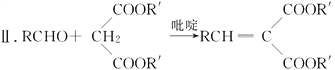
已知:
Ⅰ.RCOOR′+R″OH![]() RCOOR″+R′OH
RCOOR″+R′OH
(R,R′,R″表示氢原子、烷基或芳基)
回答下列问题:
(1)反应②属于取代反应,则A中官能团的名称是________
(2)  的名称是________,反应⑤的反应类型为________。
的名称是________,反应⑤的反应类型为________。
(3)反应⑥的化学方程式是________________________________________。
(4)已知G分子中含有2个六元环。下列有关说法正确的是________(填标号)。
a.核磁共振仪可测出E有5种类型的氢原子
b.质谱仪可检测F的最大质荷比的值为236
c. G分子中的碳原子均可以共面
d.化合物W能发生加聚反应得到线型高分子化合物
(5)某芳香化合物Q是4羟基扁桃酸的同分异构体,具有下列特征:①苯环上只有3个取代基;②能发生水解反应和银镜反应;③1 mol Q最多能消耗3 mol NaOH。Q共有________种(不含立体异构)
(6)仔细观察由乙醇合成香豆素-3-羧酸的过程,结合相关信息,当乙醇与丙二酸的物质的量的比为_______时,只许3步即可完成合成路线。请写出合成路线_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)以下物质中:①酒精 ②熔化的KNO3 ③CaCO3 ④氢氧化钠溶液 ⑤铜 ⑥SO2
其中属于电解质的是_________(填编号,下同),属于非电解质的是__________。
(2)画出氟离子的结构示意图________________;用于制造光导纤维的物质的化学式_______。
(3)已知加热条件下氯气和NaOH溶液可发生以下反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O
a.标出上面反应电子转移的方向和数目_______。
b.以上反应中氧化剂与还原剂的物质的量之比为_________。
c.若有21.3g Cl2参加反应,转移的电子数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的NO和足量C发生化学反应:C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是

A. 增大压强或升高温度,NO转化率均增大
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时v正>v逆
D. 若状态B、C、D的压强分别为PB、PC、PD,则PC=PD>PB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取等物质的量浓度的NaOH溶液两份A和B,每份100mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸体积之间的关系如图所示。下列说法正确的是
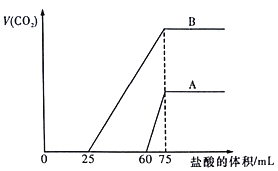
A. B曲线中消耗盐酸0<V(HCl)<25mL时发生的离子反应为: OH-+H+=H2O,H++CO32-=HCO3-
B. 原NaOH溶液的物质的量浓度为0.75mol/L
C. B曲线最终产生的CO2体积(标准状况下)为112mL
D. 加盐酸之前A溶液中的溶质是碳酸钠和碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示。下列说法正确的是

A. 石墨电极上发生氧化反应 B. 通甲烷的电极反应式:CH4+4CO32--8e-=5CO2+2H2O
C. 通空气的电极反应式为O2+4e-=2O2- D. 甲烷燃料电池中CO32-向空气一极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶金工业中,从冶铅废渣中再提取铅的工艺流程如下:
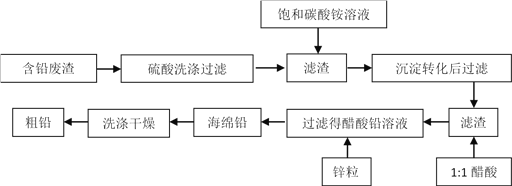
已知:Ksp (PbSO4) =1.6×10 -8;Ksp (PbCO3) =8.0×10 -14;醋酸铅易溶于水,难电离。
回答下列问题:
(1)此化工工艺达到了以下哪些目的:______________
A.减少环境污染 B.提高资源利用率 C.制备醋酸铅 D.制备了纯铅
(2)硫酸洗涤后,生成的PbSO4表面常含有铜单质,为溶解铜,常需要同时加入一定量的H2O2溶液,写出溶解铜的离子方程式:_________________________________;为加快此反应的速率,下列方法合适的是:_____________。
A.搅拌 B.适当加热 C.减压 D.将PbSO4固体粉碎
(3)加入碳酸铵溶液后PbSO4转化为PbCO3。转化的方程式为:PbSO4(s)+CO32-(aq)=PbCO3(s)+SO42-(aq),通过计算,说明该反应能进行的原因:_________________________。这一步骤中,也可以将碳酸铵改用碳酸氢铵,但实际生产效果不好,请说明其中的一个原因:______________________________________________________。
(4)处理含铅废渣1000g(含铅以PbSO4计,质量分数为0.303),若回收率为 95% 。经原子吸收分光光度法及 EDTA 滴定法测定,产品(粗铅)纯度为 90%。则得到的粗铅质量为(保留一位小数)______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com