


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.方法③是最经济和环保的 |
| B.方法①中,若从经济和环保的角度考虑,用稀硝酸比用浓硝酸好 |
| C.方法②需要消耗能源,对环境不产生污染 |
| D.方法③中N2O4既是氧化剂又是还原剂 |
查看答案和解析>>
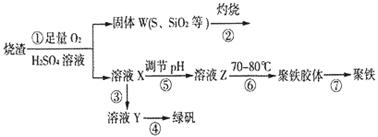
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH | ≥9.6 | ≥6.4 | 3~4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na,Mg,Al | B.Na,K,Zn,Fe |
| C.Zn,Fe,Cu,Ag | D.Mg,Al,Zn,Fe |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应后的溶液中加入氯水不变色 |
| B.反应后的溶液可继续溶解金属铜 |
C.原混台物中氧化铁的物质的量为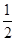 (a-b)mol (a-b)mol |
| D.原混合物中单质铁的物质的量为b mol |
查看答案和解析>>
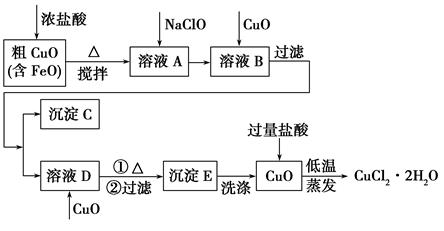
科目:高中化学 来源:不详 题型:填空题
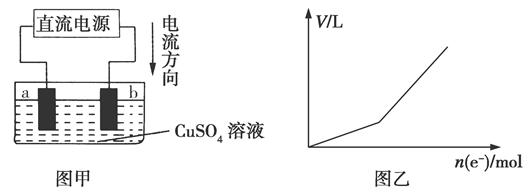
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
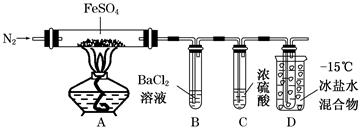
| 实验 | 实验过程 | 实现现象 |
| ① | 通入一段时间N2,加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
| ② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
| ③ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
| ④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
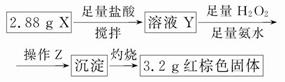
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com