
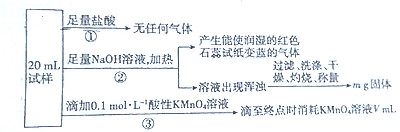
| A. | 由实验①可推断原混合溶液中一定不存在${NO}_{2}^{-}$、${CO}_{3}^{2-}$ | |
| B. | 由实验①③可推断原混合溶液中一定存在Fe2+,一定不存在${NO}_{3}^{-}$ | |
| C. | 原混合溶液中肯定存在${NH}_{4}^{+}$、Fe2+、${SO}_{4}^{2-}$ | |
| D. | 如果给出m、V的具体数据,可以确定Al3+、Fe3+是否存在 |
分析 ①向第一份试样中加入足量的盐酸,无任何气体生成,说明溶液中无NO2-和CO32-;
②向第二份试样中加入足量的额氢氧化钠溶液然后加热,有使红色石蕊试纸变蓝的气体产生,则气体为NH3,说明原溶液中有NH4+; 溶液出现浑浊,说明溶液中有Fe2+、Fe3+中的一种或两者均有,但无论含的是Fe2+还是Fe3+,沉淀后经过滤、洗涤、干燥、灼烧后所得的mg固体均为Fe2O3;
③向第三份溶液中加入KMnO4溶液进行滴定,说明溶液中一定含Fe2+,而既然含Fe2+,在向溶液中加盐酸时却无任何气体生成,说明溶液中一定无NO3-,而根据溶液要呈电中性可知,溶液中一定含SO42-,据此分析.
解答 解:①向第一份试样中加入足量的盐酸,无任何气体生成,说明溶液中无NO2-和CO32-;
②向第二份试样中加入足量的额氢氧化钠溶液然后加热,有使红色石蕊试纸变蓝的气体产生,则气体为NH3,说明原溶液中有NH4+; 溶液出现浑浊,说明溶液中有Fe2+、Fe3+中的一种或两者均有,但无论含的是Fe2+还是Fe3+,沉淀后经过滤、洗涤、干燥、灼烧后所得的mg固体均为Fe2O3;
③向第三份溶液中加入KMnO4溶液进行滴定,说明溶液中一定含Fe2+,而既然含Fe2+,在向溶液中加盐酸时却无任何气体生成,说明溶液中一定无NO3-,而根据溶液要呈电中性可知,溶液中一定含SO42-,据此分析.
即溶液中一定含NH4+、Fe2+、SO42-,一定不含NO3-、NO2-和CO32-,不能确定的是Al3+、Fe3+.
A、加入足量的盐酸,无任何气体生成,说明溶液中无NO2-和CO32-,故A正确;
B、溶液中一定含NH4+、Fe2+、SO42-,一定不含NO3-、NO2-和CO32-,故B正确;
C、溶液中一定含NH4+、Fe2+、SO42-,故C正确;
D、根据消耗的KMnO4溶液的量为V×10-4mol,可知Fe2+的物质的量n=5V×10-4mol,所得的mg固体均为Fe2O3,根据铁元素的守恒可求出Fe3+的物质的量n=$\frac{m}{160}×2mol-5V×1{0}^{-4}mol$=$(\frac{m}{80}-5V×1{0}^{-4})$mol,但求不出Al3+的物质的量,故D错误.
故选D.
点评 本题考查了离子的检验和有关离子量的求算,应注意的是无论是Fe2+还是Fe3+,在沉淀后经过过滤、洗涤、干燥、灼烧后所得的固体均为Fe2O3.


科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯和水,酒精和脂肪,苯和汽油 | |
| B. | 油脂和水,溴苯和水,硝基苯和水 | |
| C. | 甲醛和水,蚁酸和水,乙酸和乙醇 | |
| D. | 汽油和水,苯和甲苯,鸡蛋白和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
氨的平衡(MP)含量%压强温度(℃) | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.5g | B. | 13.2g | C. | 19.7g | D. | 24.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
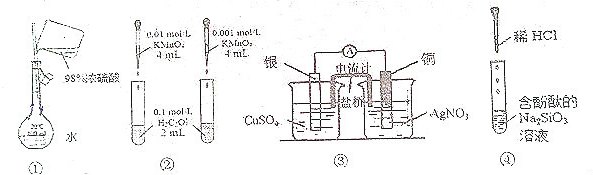
| A. | 装置①配制一定的物质的量浓度的稀硫酸溶液 | |
| B. | 装置②根据溶液褪色的快慢比较浓度对反应速率的影响 | |
| C. | 装置③制作原电池 | |
| D. | 装置④制备硅胶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | 只有② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的正反应为放热反应 | |
| B. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 反应的热化学方程式可表示为:CO(g)+H2O(g)$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$CO2(g)+H2(g)△H<0 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com